
【题目】用化学方程式表示下列事实
(1)纯净的氢气在空气中燃烧:_____。
(2)服用含氢氧化铝的药物治疗胃酸过多症:_____。
(3)向盛有少量碳酸钠溶液的试管里滴入澄清石灰水:_____。
(4)锻烧石灰石制取生石灰:_____。
(5)实验室用高锰酸钾制备氧气:_____。
【答案】2H2+O2![]() 2H2O Al(OH)3+3HCl═AlCl3+3H2O Na2CO3+Ca(OH)2═CaCO3↓+2NaOH CaCO3
2H2O Al(OH)3+3HCl═AlCl3+3H2O Na2CO3+Ca(OH)2═CaCO3↓+2NaOH CaCO3![]() CaO+CO2↑ 2KMnO4
CaO+CO2↑ 2KMnO4 ![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
【解析】
(1)氢气燃烧生成水,反应的化学方程式:2H2+O2![]() 2H2O。故填:2H2+O2
2H2O。故填:2H2+O2![]() 2H2O。
2H2O。
(2)氢氧化铝和盐酸反应生成氯化铝和水,反应的化学方程式:Al(OH)3+3HCl═AlCl3+3H2O。故填:Al(OH)3+3HCl═AlCl3+3H2O。
(3)碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。故填:Na2CO3+Ca(OH)2═CaCO3↓+2NaOH。
(4)高温条件下碳酸钙分解生成氧化钙和二氧化碳,反应的化学方程式:CaCO3 ![]() CaO+CO2↑。故填:CaCO3
CaO+CO2↑。故填:CaCO3![]() CaO+CO2↑。
CaO+CO2↑。
(5)高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,反应的化学方程式:2KMnO4 ![]() K2MnO4+MnO2+O2↑。故填:2KMnO4
K2MnO4+MnO2+O2↑。故填:2KMnO4 ![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:初中化学 来源: 题型:
【题目】江西南昌海昏侯墓考古发掘出大量金器、竹简、玉器和青铜器等文物。请用恰当的化学用语表示下列带点文字部分:
(1)文物中含有的金属元素:_____(写出一种即可)。
(2)某些玉器中含有氧化铝:_____。
(3)青铜器表面上附着少量铜绿[Cu2(OH)2CO3],铜绿中氢氧根离子的化合价为-1价:_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是

A.参加反应的X和Y的粒子个数比为1:1
B.Z在空气中的质量分数约为78%
C.参加反应的X与Y的质量比为3: 2
D.W是分子构成的物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(10宁夏16).下图是某化学反应的微观粒子示意图。
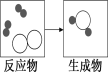
(1)两种反应物的共同之处是:每个分子都 。 该反应的基本类型属于 ,写一个符合这一反应类型的化学方 程式 。
(2)根据化学反应的本质,生成物的方框内还应补充的粒子及数目是( )
A.一个 ![]() B.两个
B.两个![]() C.一个
C.一个![]() D.两个
D.两个![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知盐酸、硫酸与氢氧化钠、氢氧化钾反应生成的盐的水溶液显中性。现将某蓝色晶体A溶入某一无色中性溶液中,按下图所示过程进行实验:
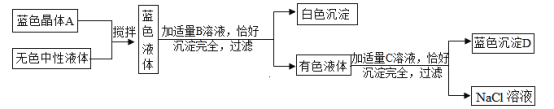
(1)无色中性溶液是含有一种溶质的溶液,则其溶质是_____(填化学式);B溶液中溶质的化学式为_____。
(2)写出有色液体与C溶液反应的化学方程式:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】运用溶解度表与溶解度曲线回答下列问题:
温度/°C | 10 | 30 | 50 | 60 | |
溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
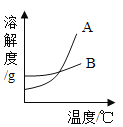
(1)B是 _____________(填“氯化钠”或“硝酸钾”)的溶解度曲线。
(2)60℃时,向100g水中加入100g硝酸钾,所得溶液的溶质质量分数为_____________,当该溶液从60℃降温到30℃时,析出晶体的质量为_____________g。
(3)现有50℃A物质的不饱和溶液,在不减少溶剂的情况下,欲使其变成饱和溶液,下列措施肯定不能实现的是_____(填序号)。
①降低温度 ②升高温度 ③加入A物质
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学生具备化学实验技能是进行科学探究活动的基础和保证。下列图示实验操作中正确的是
A.  称量固体 B.
称量固体 B. 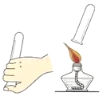 检验H2的纯度
检验H2的纯度
C.  倾倒液体 D.
倾倒液体 D.  测溶液的pH
测溶液的pH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜晶体(CuSO4﹒5H2O)常用于印染的媒染剂,农业和渔业的杀虫剂、工业镀铜等。
[物质制备]某兴趣小组同学查找到以辉铜矿(主要成分是硫化亚铜,化学式为Cu2S) 为主要原料制备硫酸铜晶体的工业生产过程:
[资料1 ]硫化亚铜(Cu2S)高温时能与空气中的氧气反应生成氧化铜和二氧化硫气体。
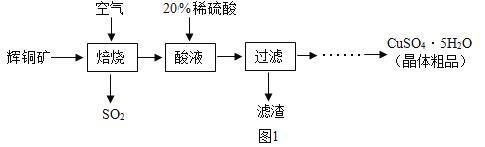
(1)Cu2S中铜元素的化合价为______________。
(2)焙烧过程中为了让辉铜矿充分反应,可以采取的措施是______________。
(3),上述“酸溶”过程中发生反应的化学方程式是______________。上述流程中产生的SO2可用于工业上生产硫酸。
(4)制得硫酸铜晶体粗品的过程是:将滤液经蒸发浓缩、降温结晶、_________、洗涤、 低温干燥而获得。
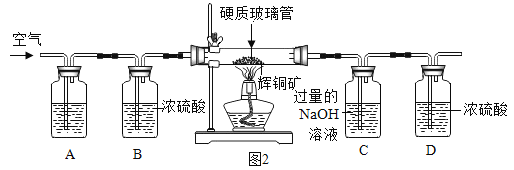
[含量测定]该兴趣小组的同学为测定某辉铜矿中硫元素的含量,进行了如下的实验探究。(假设每步反应均完全,不考虑装置内原有空气对测定结果的影响)。该实验小组设计了下列装置,取6g辉铜矿样品,放入硬质玻璃管中。
充分反应后,取C瓶中的溶液进行了如下图处理:
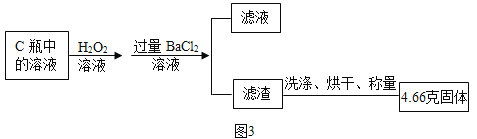
[资料Ⅱ]亚硫酸钠(Na2SO3) 与过氧化氢反应能生成硫酸钠和水。
[问题讨论] (5)图2装置中A瓶内.所盛的试剂是NaOH溶液,其作用是______________;C瓶中NaOH溶液的作用是______________。
(6)图3实验过程中必须对滤渣进行洗涤,证明滤渣洗净所用试剂是_____________溶液,若缺少洗涤操作则会使测得的硫化亚铜的含量_____________(选填“偏大”、“偏小”或“不变”)。
(7)图3实验过程中,加入过量BaCl2溶液时发生反应的化学方程式为______________;该辉铜矿中硫元素的质量分数为______________。(假设辉铜矿中只有Cu2S 含有S元素,且转化过程中无硫元素的损失)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com