
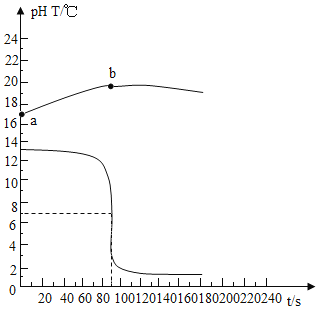
【题目】实验小组用传感器研究稀盐酸和稀NaOH溶液的反应。实验过程中温度和pH变化趋势如下图所示。
(1)上述反应的化学方程式是______。
(2)曲线a ~ b上升的原因是______。
(3)下列说法正确的是______(填序号)。
A 该实验是将稀盐酸滴入稀NaOH溶液中
B 60 s时对应溶液中的溶质是NaCl
C 120 s时向溶液中加入酚酞,溶液不变色
D 180 s时向溶液中加入Na2CO3溶液,能证明稀盐酸和稀NaOH溶液发生反应
【答案】![]() 氢氧化钠和稀盐酸反应放热 AC
氢氧化钠和稀盐酸反应放热 AC
【解析】
稀盐酸和氢氧化钠反应生成氯化钠和水。
(1)稀盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式是![]() 。
。
(2)由图可知,a ~ b所在的曲线是温度变化曲线,氢氧化钠和稀盐酸反应放热,a ~ b段温度升高,故曲线a ~ b上升的原因是氢氧化钠和稀盐酸反应放热。
(3)A、开始溶液的pH大于7,溶液显碱性,最终溶液的pH小于7,溶液显酸性,则该实验是将稀盐酸滴入稀NaOH溶液中,故A正确;
B、60 s时,pH>7,溶液显碱性,说明氢氧化钠未完全反应,氢氧化钠与稀盐酸反应生成氯化钠和水,故对应溶液中的溶质是氢氧化钠、氯化钠,故B不正确;
C、120 s时,溶液显酸性,酸不能使酚酞溶液变色,则向溶液中加入酚酞,溶液不变色,故C正确;
D、180 s时溶液中的稀盐酸过量,稀盐酸和碳酸钠反应,生成二氧化碳气体,有气泡产生,氢氧化钠与碳酸钠不反应,无法验证氢氧化钠是否存在,不能证明氢氧化钠与稀盐酸发生了反应,故D不正确。故选AC。


科目:初中化学 来源: 题型:
【题目】结合如图所示实验,回答下列问题

(1)在实验A中,玻璃棒的作用是_________________;实验B中玻璃棒的作用是_________________。
(2)控制变量法是学习化学常用的方法。图乙是探究燃烧条件的实验,请你根据实验图示和资料信息回答有关问题。资料信息:白磷和红磷的着火点分别是40°C、240°C。
①实验中,铜片上的红磷不燃烧,是因为_________________。
②水中的白磷不燃烧,是因为_________________。
③如果要让水中的白磷在水下燃烧,应采取的措施是_________________。
④燃着的白磷熄灭后,去掉铜片上的白色固体,可看到铜片表面变黑。该黑色物质是________________(填化学式)
(3)丙实验用pH试纸测定白醋的酸碱度时,先用蒸馏水润湿试纸则测得结果与实际值相比______________(选择“偏大”、“偏小”或“相等”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高炉炼铁所需的原料有铁矿石、焦炭、石灰石等,其过程可用下图简要表示:
已知气体①、气体②和固体③均属于氧化物。
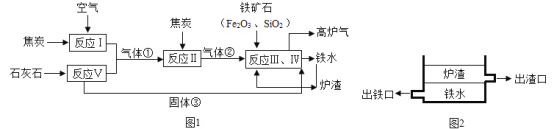
(1)气体②的化学式为_____。根据氧化物的性质推测炉渣的主要成分为_____(填化学式)。
(2)炼铁高炉底部通过不同高度的出口分离铁水与炉渣(如图2所示)。能实现渣铁分离的原因是是因为炉渣具有_____、_____的性质。
(3)反应Ⅰ~Ⅴ中属于化合反应的有_____个,属于分解反应的有_____个,属于置换反应的有_____个。
(4)高炉气体中含有多种成分,其中含量最高(占55%~60%)的是_____(填化学式),此外还含有25~30%的可燃性气体_____(填化学式),以及9~12%左右的_____(填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】Al-CO2电池是一种新型电池。电池的工作原理:在O2的催化下,Al与CO2发生化合反应生成Al2(C2O4)3。 下列关于Al2(C2O4)3的说法正确的是
A.由一种金属和两种非金属组成
B.铝、碳、氧元素质量比为1:3:6
C.碳元素的化合价为+3
D.Al2(C2O4)3 中原子总数为20
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A. 碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3)g
B. 碳酸乙烯酯中C、H、O三种元素的质量比为12:1:16
C. 碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
D. 碳酸乙烯酯中碳元素的质量分数= ![]() ×100%
×100%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验小组同学探究金属的化学性质。他们将打磨好表面积相同的铝片分别放入不同浓度的稀盐酸中,结果发现产生气泡的速率明显不同。
(1)写出该反应的化学方程式:_____。
(2)实验小组的同学根据所学的知识得出:_______影响了该反应速率。
(3)打磨铝片的目的:_______。
实验小组的同学偶然发现把硫酸铜溶液加入到上述试管中,发现反应的速率明显加快。
[提出问题] 硫酸铜溶液中的什么粒子导致反应速率明显加快的?
[作出猜想] 猜想一:硫酸铜溶液中的水分子;
猜想二:硫酸铜溶液中的硫酸根离子;
猜想三:______;
上述猜想____肯定是错误的,原因:____。
[进行实验]
取三只干净的试管,分别向试管中加入打磨干净的表面积相同的铝片,再分别加入相同体积相同浓度的稀盐酸:
(1)向第一支试管中加入氯化钠晶体,观察到产生气泡的速率不变,得出_离子对实验没有影响;
(2)向第二支试管中加入__晶体,观察到产生气泡的速率不变,得出硫酸根离子对实验没有影响;
(3)向第三支试管中继续加入___晶体,观察到产生气泡的速率明显加快,得出猜想三成立;
[反思] 上述实验的第3步,还可以加入___晶体,也可以验证猜想三成立。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质的溶解度曲线,下列分析正确的是
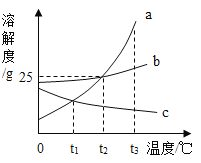
A.t2℃时,100gb的饱和溶液中含有b物质25g
B.t3℃时,分别将a、b的饱和溶液降温至t2℃,析出的固体质量a>b
C.分别将t1℃时a、c的饱和溶液升温到t2℃,均变为不饱和溶液
D.a中含有少量b时,可采用冷却a的热饱和溶液的方法提纯a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com