




科目:初中化学 来源:不详 题型:实验题
| 实验方法 | 可能观察到的现象 | 结论 |
| | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 实验步骤 | 实验现象 | 实验结论 |
| ①将易拉罐口打开,迅速用燃着的木条伸入罐口。 | 发出“噗”的一声,产生淡蓝色火焰,片刻后熄灭。 | 说明罐中重新生成的气体A是________。 |
| ②取少量铝片于试管中,先加入适量的水,片刻后再加入少量的氢氧化钠溶液。 | 先加水,没有明显变化,后加入氢氧化钠溶液后产生无色无味的气体。 | 说明铝是否与水直接反应:______(填 “是”或“否”),铝能够与_______溶液反应。 |
| ③取少量易拉罐中反应后的溶液于试管中,加入过量的稀盐酸。 | 产生了无色无味气体,该气体能使澄清石灰水变浑浊。 | 说明原CO2气体被NaOH溶液吸收。 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
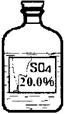
| 物 质 | H2SO4 | Na2SO4 | MgSO4 |
| 常温下的溶解度∕g | 与水以任意比互溶 | 18.0 | 39.0 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.向洗净的碎鸡蛋壳中加入食盐水可制得二氧化碳 |
| B.用适量的水能区分氧化铜和二氧化锰 |
| C.粗盐提纯实验中,蒸发结晶至有较多固体析出时停止加热 |
| D.用pH试纸测定溶液酸碱度时,先将pH试纸用水湿润,然后再测定 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题


查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
| 试管号 | 1%淀粉溶液 | 1%稀硫酸 | 蒸馏水 | 碘液 |
| 1 | 2mL | 0 | 1mL | 2滴 |
| 2 | 2mL | 1mL | 0 | 2滴 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题

| A.氢氧化钠溶液、二氧化碳 |
| B.酒精、氧气 |
| C.氢氧化钾溶液、氯化氢 |
| D.水、一氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com