
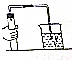
 检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气.
检查装置的气密性(如图),连接好仪器,先将导管的一端浸没在水里,然后双手紧贴容器外壁,若导管口有气泡冒出,移开手,在导管内形成一段水柱,则不漏气. 科目:初中化学 来源: 题型:解答题
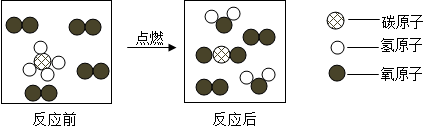
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
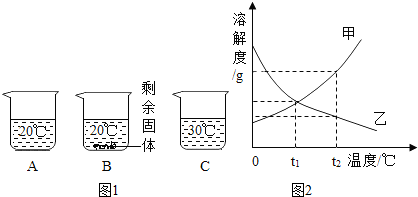
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
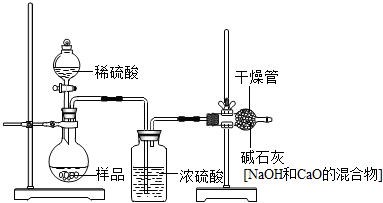
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com