
【题目】某兴趣小组用图1 装置进行实验时发现,烧杯中饱和石灰水先变浑浊,后逐渐澄清。
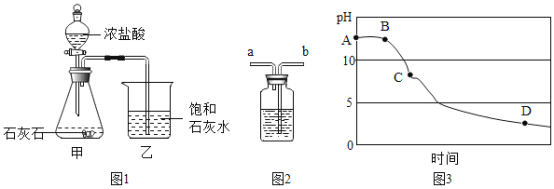
(1)写出甲装置中发生反应的化学方程式_______。
(2)为探究“饱和石灰水浑浊后变澄清的原因”,该小组同学开展了如下活动:
(查阅文献)碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于的碳酸氢钙(碳酸氢钠等)。
(提出假设)假设 1:挥发出的HCl使浑浊变澄清;假设2:______。
(设计实验)同学们设计实验证明假设1正确。为证明假设2,他们如下设计:为除去CO2中的HCl,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→____→____→乙(填字母序号);其中存放的试剂合理的是_______(填选项序号)。
A 浓硫酸 B 饱和Na2CO3溶液 C 饱和NaHCO3溶液
(实验现象)饱和石灰水浑浊后,继续通入足量 CO2 ,沉淀部分溶解但最终并未完全澄清。
(得出结论)由以上探究可得出结论是___________。
(3)该兴趣小组在老师指导下,用 pH 传感器测得图 1烧杯中溶液的 pH 随通入时间的变化曲线如图3。D点所得溶液的成分除 H2O外还有_________。
【答案】![]() 产生的二氧化碳使石灰水变澄清 b a C 假设1成立 盐酸(HCl)和氯化钙(CaCl2)
产生的二氧化碳使石灰水变澄清 b a C 假设1成立 盐酸(HCl)和氯化钙(CaCl2)
【解析】
(1)甲装置中石灰石的主要成分碳酸钙,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式是:![]() ;
;
(2)提出假设:
由文献资料,碳酸钙(碳酸钠等)与二氧化碳、水反应生成可溶于水的碳酸氢钙,则可提出假设产生的二氧化碳使石灰水变澄清;
设计实验:
图中装置用作洗气瓶时,进气管与出气管的方向是“长进短出”,小华在图1中甲、乙装置之间增加图2装置,装置的连接顺序是甲→b→a→乙;其中盛放的试剂合理的是碳酸氢钠溶液,碳酸氢钠能与氯化氢气体反应生成氯化钠、水和二氧化碳,能除去杂质且没有引入新的杂质,符合除杂原则。
得出结论:
根据饱和石灰水浑浊后,继续通入足量CO2,沉淀部分溶解但最终并未完全澄清可得出的结论是挥发出来的氯化氢使饱和石灰水产生的浑浊最终变澄清,假设1成立;
(3)D点溶液的pH小于5,所得澄清溶液的成分除H2O外,还有氯化氢气体溶于水生成的盐酸(HCl),氯化氢与氢氧化钙反应生成的氯化钙(CaCl2)。


科目:初中化学 来源: 题型:
【题目】“双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等。化学兴 趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如下图所示。同学们 对这包久置的“双吸剂”固体 样品很好奇,设计实验进行探究。

(提出问题)久置“双吸剂”固体的成分是什么?
(查阅资料)
①铁与氯化铁溶液在常温下反应生成氯化亚铁:Fe+2FeCl3=3FeCl2;
②碱性的 Na2CO3溶液可以与中性的 CaCl2 溶液发生复分解反应。
(作出猜想)久置固体中可能含有 Fe、Fe2O3、CaO、Ca(OH)2 和 CaCO3。
(定性研究)小明取少量样品放入试管中,加入一定量的稀盐酸,发现,试管中固体质量逐渐减少,生成一种 能使澄清石灰水变浑浊的气体,得到浅绿色溶液,他初步判断:样品中一定含有_____,一定不含 Fe2O3。
(实验质疑)小组同学谈论认为上述实验并不能得出一定不含 Fe2O3的结论,理由是_____,(用化学方程式表示)。为进一步确定这包久置的“双吸剂”固体的成分进行如下定量实验。
(定量研究)取 3g 样品研碎,并用磁铁充分吸引后,得到剩余固体 2. 6g,按照如图流程进行实验,请回答相 关问题:
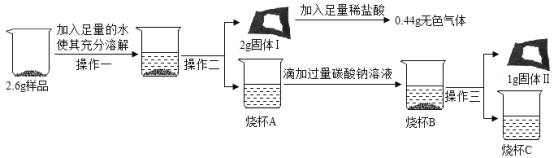
(1)操作二、操作三名称是_________________________。
(2)固体 I 的成分是_______________________。(填物质化学式,下同);
(3)写出生成固体Ⅱ的化学方程式_______________________。
(4)根据定性、定量研究中现象的分析及有关数据计算判断,这包久置“双吸剂”固体的成分中氧化钙的质量小于__________________。
(实验反思)结合上面的实验,下列说法正确的是______________________(填字母序号)
A对物质成分的研究有时需要定性和定量相结合
B在原样品中加入足量盐酸有 4 个反应发生
C定量研究烧杯 C 中的溶质为 NaOH 和 Na2CO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝热反应常用于冶炼或焊接金属,一个铝热反应的化学方程式为:3CuO+2Al![]() 3Cu+Al2O3.某化学兴趣小组将一定量铝粉和氧化铜混合加热,反应一段时间后停止加热。为了探究剩余固体A的组成,该小组取少量剩余固体A加入一定量稀硫酸,充分反应后,再将铁片插入上层溶液中。关于该探究的下列说法:
3Cu+Al2O3.某化学兴趣小组将一定量铝粉和氧化铜混合加热,反应一段时间后停止加热。为了探究剩余固体A的组成,该小组取少量剩余固体A加入一定量稀硫酸,充分反应后,再将铁片插入上层溶液中。关于该探究的下列说法:
①若加入稀硫酸充分反应后容器底有红色物质出现,则剩余固体A中一定含有CuO和Al
②若加入稀硫酸后,有气泡生成,则剩余固体物A中一定含有铝粉,可能含有铜粉
③若加入稀硫酸后,没有气泡生成,则此时溶液可能为蓝色
④若剩余固体A中有氧化铜,则加入稀硫酸充分反应后插入的铁片表面一定有红色物质生成
⑤若加入稀硫酸充分反应后溶液呈蓝色,则加热反应后的剩余固体中一定含有CuO
其中不正确的是( )
A.①②④B.①②⑤C.①③④D.②③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)我国海盐年产量3千多万吨,居世界第一位,目前从海水中提取食盐的过程如图所示:
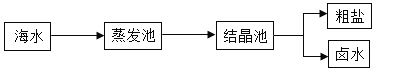
在上述过程中,下列说法不正确的是_______(填选项序号)。
A 水分蒸发所需能量主要为太阳能
B 在结晶池中主要通过降温结晶使氯化钠析出
C 风吹加速了水分的蒸发
D 当氯化钠晶体析出时,结晶池中的溶液为氯化钠的饱和溶液
(2)某学习小组的同学欲将粗盐进行初步提纯,进行了如下操作过程:
①取少量粗盐,加水搅拌至粗盐不再溶解;
②将步骤①所得混合液进行过滤,所使用的装置如下图所示;
③将步骤②所得滤液置于蒸发皿中加热蒸发,从而得到初步提纯后的精盐。
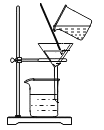
请指出(或改正)图中的一项错误_____________________________。
(3)1826年,比利时化学家索尔维发明了氨碱法制纯碱,以海水晒盐所得氯化钠为原料,配以水、氨气、二氧化碳制得纯碱。化学反应原理为:![]() ,
, ![]() .1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法),是向滤出 NaHCO3晶体后的NH4C1溶液中加入NaCl粉末,析出可用作肥料的NH4Cl. NH4Cl和NaHCO3的溶解度曲线如图所示:
.1926年,我国化学家侯德榜在氨碱法的基础上,创立了更为先进的联合制碱法(侯氏制碱法),是向滤出 NaHCO3晶体后的NH4C1溶液中加入NaCl粉末,析出可用作肥料的NH4Cl. NH4Cl和NaHCO3的溶解度曲线如图所示:
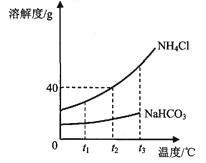
①当温度高于t3℃时, NaHCO3无溶解度数值,原因是____________________________;
②t2℃时,向200g水中加入40g氯化铵充分溶解,所得溶液是氯化铵的____溶液(填“饱和”、“不饱和之一);
③氨盐水吸收二氧化碳后生成NaHCO3和NH4Cl的过程中, NaHCO3首先从溶液中析出,原因是________填序号).
A 相同温度下, NaHCO3的溶解度小于NH4Cl B NaHCO3的溶解度受温度影响比氯化铵小
C NaHCO3的化学性质比氯化铵稳定 D 生成的 NaHCO3的质量比NH4Cl大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学与我们的生活息息相关,同学们要学以致用。
(1)小王同学往厨房的纯碱中滴加白醋,发现有气体生成。此反应的基本类型属于_________。
(2)下列生活中的做法正确的是(请填写番号字母)___________。
A 用生石灰作食品干燥剂
B 用汽油或加了洗涤剂的水来除去衣服上的油污
C 燃气灶的火焰出现橙色或黄色时,可调小炉具进风口
D 钢铁表面采用涂油、刷漆、镀铬等方法都能防止钢铁生锈
E 用压缩天然气代替汽油作为汽车燃料,可减少对空气的污染
(3)有一种家用环保型消毒液发生器,其中发生的主要反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为______;从能量变化角度看,该反应将电能转化为______能;
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是化学独特的语言,也是学习化学的重要工具。
(1)按要求从氢气、氧气、氧化钙、氢氧化钠、氢氧化镁、硝酸钾中选择合适的物质,将其化学式填写在下列横线上:
①一种可以燃烧的气体__________。
②一种难溶于水的碱____________。
③一种常见的食品干燥剂___________。
④一种复合肥料___________。
(2)国家卫生部规定:室内公共场所禁止吸烟。香烟燃烧产生的烟雾中主要含有一氧化碳、尼古丁和焦油,这三种物质被称为香烟的三大杀手。试回答下列问题:

①尼古丁的化学式为C10H14N2,该物质的一个分子中, 氢、氮两种原子的个数比为___________(填最简整数比)。
②尼古丁中,碳、氮两元素的质量比为___________(填最简整数比)。
③一氧化碳、尼古丁和焦油中,属于无机物的是___________。
④下列说法中,不正确的是________ (填序号)。
A吸烟会产生依赖性 B焦油能诱发细胞病变
C被动吸烟无害 D生活中应远离有毒、有害物质
(3)2017年5月18日,我国南海神狐海域的可燃冰试采取得圆满成功,实现历史性突破。可燃冰的主要成分是甲烷,试写出甲烷在空气中完全燃烧的化学方程式:__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,通过化学学习,我们进一步认识到水的重要作用.
(1)自然界的水常常遭到人为污染,污染物中氮和磷含量过高会造成水中藻类过度繁殖,使水质恶化,这里的“氮和磷”是指 ;(填字母)
A.元素 B.原子 C.离子 D.分子
(2)自然界的水经过一系列净化处理后,成为比较清洁的自来水.自来水不是纯水,若要制取纯水,应采取的净化方法是 .碗碟上的油污用自来水很难洗净,往水中加少量的洗涤剂后,就容易洗洗净,说明洗涤剂具有 作用.
(3)20℃时,向两只试管中加入等质量的甲、乙两种固体物质,分别加入10g水,使其充分溶解,观察到如图所示的现象.

20℃时, (填“甲”或“乙”)的溶液一定是饱和溶液.上图中表示甲物质的溶解度曲线的是 (填“a”或“b”)要使试管中剩余的甲固体继续溶解可采用的方法是 .将10℃时a的饱和溶液升温到20℃(溶剂不蒸发),其溶质质量分数 (填“变大”、“变小”或“不变”).
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制取和收集气体的装置,请按要求作答:
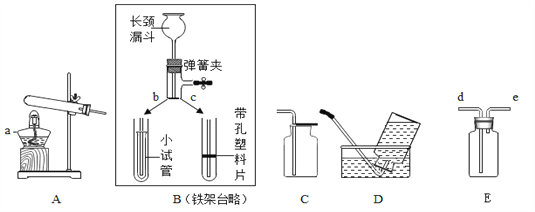
(1)用B装置制取气体并能随时停止反应,上部与下部对接应选______ (填“b”或“c”),检查该组合装置气密性的方法是________________________;
(2)从装置A~D中选择:加热氯酸钾制取并收集较为纯净的02,应选用图中的______和______ (填字母),化学方程式为___________________________________________:
(3)用E装置收集H:,则气体从______ (填“d”或“e”)导管口进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
知识回顾:在打开浓盐酸时常会看到瓶口有_____的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变_____(填“大”、“小”)。
(实验探究Ⅰ)探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:紫色石蕊试液、酚酞试液、锌粒、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
实验步骤 | 预计实验现象 |
取少量溶液于试管中,滴加_____ | 溶液变红色 |
另取少量溶液于试管中加入_____ | 有气泡产生 |
(实验探究Ⅱ)测定这瓶盐酸溶液中溶质的质量分数
(查阅资料)HCl+AgNO3═AgCl↓+2HNO3
(设计实验)小组同学设计了如下两套方案,请协助他们完成实验方案的设计。
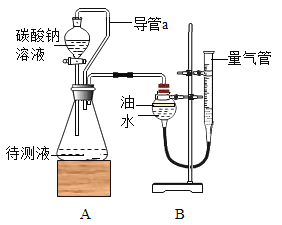
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算。取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为_____。
(3)实验过程中,当观察到_____,说明加入的碳酸钠已经足量了。
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则生成二氧化碳的体积是_____mL。
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果_____(填“有”或“没有”)影响。方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算。于是同学们另取一定量的盐酸,按如下流程进行探究:
![]()
(6)产生的白色沉淀物质是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com