某学校研究性学习小组,以某工厂生产过程中产生的废弃物“红色铁泥”为研究对象,探究红色物质的成分,请你参与他们的活动.[小组讨论]同学们对“铁泥”中所含红色物质作了如下猜想:甲同学:红色物质是铜; 乙同学:红色物质是氧化铁;
丙同学:红色物质是氢氧化铁;丁同学:红色物质是氧化铁和氢氧化铁
[资料在线]①该厂“红色铁泥”主要是生产过程中使用铁触媒(一种催化剂)后的废弃物,
除红色物质外,还含有通常不与酸、碱、氧气反应及受热不发生分解的物质;
②氢氧化铁受热时,会分解产生氧化铁和水.
[实验验证]为验证上述四位同学的猜想,小明、小红两位同学进行了如下实验:小明取一定量“红色铁泥”样品,加入稀硫酸,观察到有黄色溶液产生,于是得出“乙同学的猜想成立”的结论;
小红同学按下列顺序进行实验:先取适量已晒干的“红色铁泥”,称量其质量为m
1g;
再将“红色铁泥”置于坩埚中充分加热并在干燥器中冷却后,称量其质量为m
2g.
[问题讨论]请回答下列问题:(1)其他同学一致认为,小明同学得出的“乙同学的猜想成立”的结论不合理,理由是
;
(2)针对小红同学的实验操作及测定的两个数据,进行分析:
①若甲同学的猜想成立,则实验中反应的化学方程式为
;
②若m
1=m
2,则
(填“甲”、“乙”或“丙”)同学的猜想成立;
[拓展应用]
应用之一:若“红色铁泥”中“红色物质是氢氧化铁”,可应用下列实验方案回收“红色铁泥”
中的铁元素制得“铁红”(化学式为Fe
2O
3,是红色油漆的重要原料):
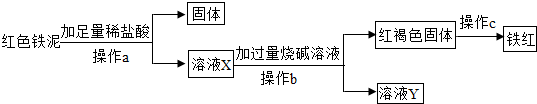
(1)上述过程中发生了三个反应,写出其中的一个化学方程式:
;
(2)a、b是同一实验操作,该操作需要的玻璃仪器有:烧杯、玻璃棒和
;
(3)若通过上述途径获得的“铁红”的纯度(Fe
2O
3的质量分数)不高,试分析可能的原因
(说出一点即可).
应用之二:为了测定用以上方法制得的“铁红”的纯度,同学们又进行了下列实验探究.请你参与过程分析与交流.
查阅资料:草酸(乙二酸H
2C
2O
4)在浓H
2SO
4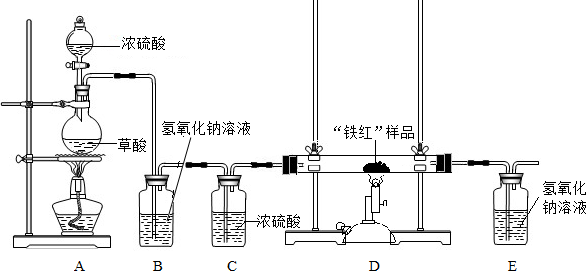
存在下发生下列反应:
H
2C
2O
4CO↑+CO
2↑+H
2O
实验准备:按如图安装好实验装置:
实验数据:取10g“铁红”样品进行实验,
所得实验数据有右表所示甲、乙两组:
| 甲组数据 |
乙组数据 |
| 玻璃管连同样品的质量 |
E装置连同样品的质量 |
| 实验前 |
实验后 |
实验前 |
实验后 |
| 60g |
57.6g |
100g |
107g |
分析讨论:
(1)同学们拟用纯净的CO还原“铁红”,所设计的实验装置中B、C盛放的试剂的作用
依次是
、
;
(2)从环保角度看,请你提出改进该实验装置的建议
;
(3)从实验安全和实验操作程序看,首先要检查装置的气密性,实验开始先加热
(填“A”或“D”)处,实验结束时,应
(填“先”或“后”)停止D处的加热;
(4)同学们认为,若用乙组数据进行计算“铁红”的纯度,则实验测定结果却偏大,分析造成偏大的原因可能是
;
(5)请依据甲组数据,计算该“铁红”样品的纯度.(写出计算的过程)





 石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):
石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):