
����Ŀ��Ϊ�˲ⶨijƷ�ƴ������Ϊ�Ȼ��ƣ���̼���Ƶ���������������������ʵ�飺���������ձ��ж�������11g��Ʒ��������ˮ�����Һ�����������ձ��м����������ȵ�CaCl2��ĩ���۽���ַ�Ӧ�����ɵij������ˡ�ϴ�ӡ�����õ�wg�İ�ɫ���壮ʵ���������£�
�ձ��� | �ձ��� | �ձ��� | |
����CaCl2������/g | 5.55 | 12 | 15 |
W/g | 5 | 10 | 10 |
�ش��������⣺
��1�����ձ����е���Һ���ɣ��õ� g���壬�ù����� �� ��ɣ�ֻ�ѧʽ����
��2����Ʒ��̼���Ƶ����������Ƕ��٣�
���𰸡��⣺��1�����ݱ������ݣ�11g��Ʒ���������10g̼��ƣ���11g��Ʒ��̼���Ƶ�����ΪX�����ĵ��Ȼ���Y��
��Ӧ���ɵ��Ȼ���Z����
Na2CO3+CaCl2=CaCO3��+2NaCl
106 111 100 117
X Y 10g z
106��100=X��10 111��100=Y��10 100��117=10��Z
��ã�X=10.6g Y=11.1g Z=11.7g
��11g��Ʒ��NaClΪ11g��10.6g=0.4g���ձ�����ʣ���CaCl2Ϊ15g��11.1g=3.9g�����ɵ��Ȼ���Ϊ11.7g
�����ձ����е���Һ���ɣ��õ�NaCl��CaCl2����Ϊ��0.4g+3.9g+11.7g=16g
�ʴ�Ϊ��16��NaCl��CaCl2
��2����Ʒ��̼���Ƶ���������Ϊ��10.6g/11g��100%=96.4%
�ʴ�Ϊ��96.4%
��������
��1�����ݱ������ݣ�11g��Ʒ���������10g̼��ƣ���11g��Ʒ��̼���Ƶ�����ΪX�����ĵ��Ȼ���Y����Ӧ���ɵ��Ȼ���Z����
Na2CO3+CaCl2=CaCO3��+2NaCl
106 111 100 117
X Y 10g Z
![]()
��ã�X=10.6g��Y=11.1g��Z=11.7g
��11g��Ʒ��NaClΪ11g��10.6g=0.4g���ձ�����ʣ���CaCl2Ϊ15g��11.1g=3.9g�����ɵ��Ȼ���Ϊ11.7g
�����ձ����е���Һ���ɣ��õ�NaCl��CaCl2����Ϊ��0.4g+3.9g+11.7g=16g
�������ձ����е���Һ���ɣ��õ�16g���壬�ù�����NaCl��CaCl2�����
��2����Ʒ��̼���Ƶ���������Ϊ��10.6g/11g��100%=96.4%
����Ʒ��̼���Ƶ�����������96.4%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Ǽס������ֹ�������(�����ᾧˮ)���ܽ�����ߡ�����˵����ȷ����
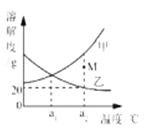
A�����ܽ�ȴ����ҵ��ܽ��
B��a1��ʱ���ס��ұ�����Һ���¶�������a2��ʱ�����й�������
C��a2��ʱ��M���Ӧ�ļ���Һ������
D��a2��ʱ���ұ�����Һ����������Ϊ20%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ش��������:
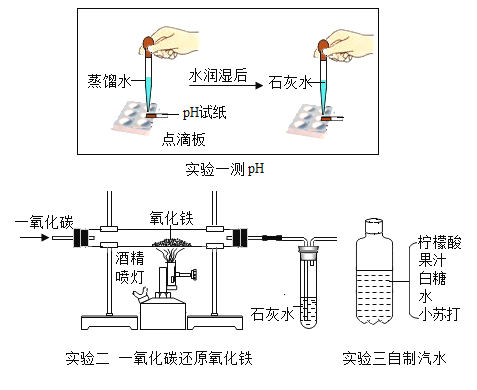
(1)ʵ��һ:�μ�Һ���Լ�������������_____________��ʵ����������ҺpH����ֵ��____ (ѡ�� ��ƫ��ƫС�����䡱)��
(2)ʵ���:ȼ�ŵľƾ��Ƶ�������_________________���������з�����Ӧ�Ļ�ѧ����ʽ__________________��
(3)ʵ����:��������ˮ�Ƿ�������ˮ����ʹ�õ�������_________________���ƺõ���ˮ��ƿ�Ǻ��д��������ݳ�������Ҫԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����п�ۺ����ۼ���һ���������������������Ļ����Һ�У���ַ�Ӧ����ˡ�
��1��д��һ�������ķ�Ӧ�Ļ�ѧ����ʽ��_____
��2������Һ��dz��ɫ����д�����ù�����һ��û�еĽ�����_____
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������-����֮�����ϵ���ǻ�ѧѧϰ����Ҫ�����������ͼʾ�ش��������⣺
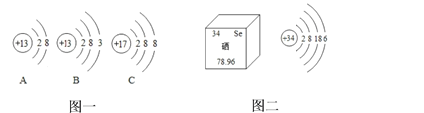
��1��A��B��C�����������ӵ���________������ĸ��ţ��������ӷ���Ϊ_________
��2����Ԫ�ر���ѧ�ҳ�Ϊ������֮��������ѧ���о�����Ѫ��ˮƽ�ĸߵ��방�ķ���ϢϢ��ء���ͼ������Ԫ�ص������Ϣ����Ԫ������___________(���������������ǽ�����)Ԫ�أ�����Ԫ�����ڱ��еڶ����ڵ�_________(��Ԫ������)��ѧ�������ƣ���Ԫ�غ���Ԫ����ɻ�����Ļ�ѧʽΪ_________
��3����ͼ��ij����Ӧ����ʾ��ͼ��
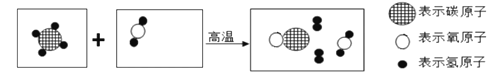
���뽫ͼʾ�����������е�������ʾ��ͼ������ȫ��ʹ��Ӧ������__________________
�����û�ѧ����ʽ��ʾ�÷�Ӧ______________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ�����ǵ�����ϢϢ��ء�
(1)��ͬ������ˮ�е��ܽ�������ͬ���������������������ε���____(д��ѧʽ����ͬ)�����ڿ����Լ����______�����ڿ������ε�_____��
����������
�����ᱵ
����������
���Ȼ���
������þ
(2)��ʢ��ˮ���ձ��м�������ij�����ʣ��γ���Һ�����У��¶Ƚ��͡�����������____(����ĸ)
A ��������
B �����
C �Ȼ���
(3)�����£����ס��ҡ������ֹ���ֱ���������֧�Թܺ�һ���ձ���ˮ�У�������ͼ1��ʾ���ס���������ʣ�࣬�ҹ���ȫ���ܽ⡣���µ� 80��ʱ�����ּ���ȫ���ܽ⣬�ҹ���������������û�����Ա仯��
�������£�______(ѡ������������������������)��Һһ���DZ�����Һ��
��ͼ2���ܱ�ʾ�����ʵ��ܽ�����ߵ���_____(����a������b������c��)��
��t1��ʱ���ס��������ʱ�����Һ������������������____��(����>��������������=��)��
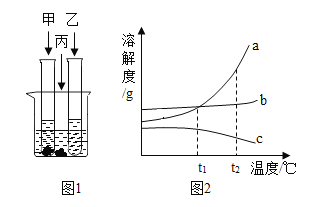
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ������ȷ��ӳ���Ӧ�仯��ϵ����(����)

A. ����һ��������KMnO4����
B. ��ʢ������H2SO4��Һ���ձ��еμ�һ��������ˮ
C. ����һ������KClO3��MnO2�Ļ����
D. ��ʢ��һ������NaOH��Na2CO3�����Һ���ձ��еμ�ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��a��b��c�������ʵ��ܽ������,a��c���ܽ�������ཻ��P�㡣��ͼ�ش�:
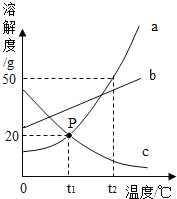
��1��P������______��
��2��t2��Cʱ,30ga���ʼ��뵽50gˮ�в��Ͻ���,����ܽ���γ���Һ��������___g,��ʱa��������������Ϊ____��
��3�� t2��Cʱ,a�� b��c�������ʵ��ܽ����С���������˳����___��
��4����t1��C��a��b��c�������ʱ�����Һ���¶����ߵ�t2Cʱ,������Һ���������������Ĵ�С��ϵ��___
A c>a=b
B a=b>c
C a>b>c
D b>a>c
��5��t2��Cʱ,��c�ı�����Һ��ɲ�������Һ,�ɲ�ȡ�ķ�����__(����һ�ַ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����MnO2Ϊԭ���Ʊ�MnSO4H2O�Ĺ�ҵ������ͼ��
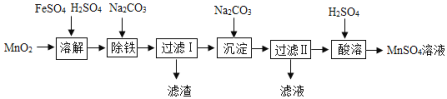
��֪���ٳ���ʱ�Ļ�ѧ����ʽΪ7MnSO4+7Na2CO3+11H2O��MnCO36Mn��OH��25H2O��+7Na2SO4+6CO2��
��MnSO4H2O��MnSO45H2O������ˮ���������Ҵ���
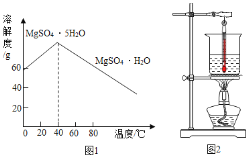
��MnSO4���ܽ��������ͼ1��ʾ��
��1���ܽ�ʱ��Ϊ����80�棬��ʵ���ҿ���ˮԡ������ͼ2��ˮԡ������Ҫ�IJ��������оƾ��ơ��� _____��_____��ˮԡ���ȵ��ŵ��Т�_____________���ܼӿ��ܽ�ķ����Т�_________��дһ�֣���
��2������ʱ��Ҫ���裬�����������____________��
��3������I������Һ��������Ҫ��Na2SO4��____________��
��4������ʱ��MnCO36Mn��OH��25H2O������ϡ���ᷴӦ�Ļ�ѧ����ʽΪ___________________��
��5���벹��������������������������MnSO4��Һ�Ʊ�MnSO4H2O��ʵ�鷽������MnSO4��Һת�����������У�___________���ڸ���40��ʱ���ȹ��ˣ�____________��100���ɵ�MnSO4H2O��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com