
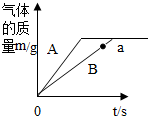
 A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.
A、B为碳酸钙块状固体和碳酸钠粉末中的某一种,在两烧杯中分别放入质量为16g的A、B两种物质,各加入109.5g溶质质量分数相同的稀盐酸,充分反应,反应产生气体的质量与反应时间的关系如图所示.分析 (1)根据粉末状物质和盐酸的接触面积大,反应速率快进行分析;
(2)根据质量守恒定律可以计算生成的二氧化碳气体的质量,根据二氧化碳气体结合化学方程式计算参加反应的氯化氢的质量,进一步计算所加稀盐酸中溶质质量分数.
解答 解:(1)粉末状物质和盐酸的接触面积大,反应速率快,所以A是碳酸钠,B是碳酸钙,生成44份二氧化碳需要73份质量的盐酸与碳酸钠反应,生成44份质量的二氧化碳需要73份质量的盐酸与碳酸钙反应,所以消耗的酸相等,B反应至a点时,碳酸钙和盐酸没有完全反应,所得溶液的溶质为CaCl2、HCl;故答案为:CaCl2、HCl;
(2)盐酸与碳酸钙块状固体和碳酸钠粉末反应中,生成二氧化碳气体的质量为16g×2+109.5g×2-237.8g=13.2g,
设稀盐酸中氯化氢的质量为x
根据盐酸与碳酸钙块状固体和碳酸钠粉末反应的方程式可得:2HCl~CO2↑
73 44
x 13.2g
$\frac{73}{x}=\frac{44}{13.2g}$
x=21.9g
所加稀盐酸中溶质质量分数为$\frac{21.9g}{109.5g×2}$×100%=10%
答:所加稀盐酸中溶质质量分数为10%.
点评 根据化学方程式进行计算时,只能使用纯净物的质量进行计算,而不能把混合物的质量直接代入化学方程式进行计算,有关反应前后质量减少的计算是初中化学计算的一个常见内容,一般的规律是依据质量的变化求出某一生成的质量.


科目:初中化学 来源: 题型:选择题
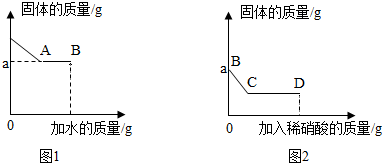
| A. | BC段只能观察到固体逐渐消失 | |
| B. | 从C到D溶液的pH逐渐增大 | |
| C. | B点时,溶液中一定没有碳酸钠和硫酸钠 | |
| D. | 白色固体中一定含有碳酸钠、硫酸钠、硝酸钡 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 用图所示装置分离CO和CO2 的混合气体,回答下列问题(提示:实验所用试剂均为足量):
用图所示装置分离CO和CO2 的混合气体,回答下列问题(提示:实验所用试剂均为足量):查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 反应物AB、D、AC | B. | 生成物AC、AD、B | ||
| C. | 催化剂为C | D. | 总共反应化学方程式为:AB+D=AD+B |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
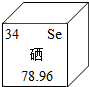 元素周期表中硒元素的某些信息如图所示,下列有关硒的说法不正确的是( )
元素周期表中硒元素的某些信息如图所示,下列有关硒的说法不正确的是( )| A. | 是金属元素 | B. | 原子核内有34个质子 | ||
| C. | 相对原子质量为78.96 | D. | 硒是人体必须的微量元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 称量项目 | 称量时间 | 质量(g) |
| 试样 | 100.00 | |
| 装置+稀硫酸质量 | 241.20 | |
| 装置+稀硫酸质量+试样 | 反应开始后15秒 | 339.20 |
| 装置+稀硫酸质量+试样 | 反应开始后35秒 | 339.00 |
| 装置+稀硫酸质量+试样 | 反应开始后55秒 | 339.00 |
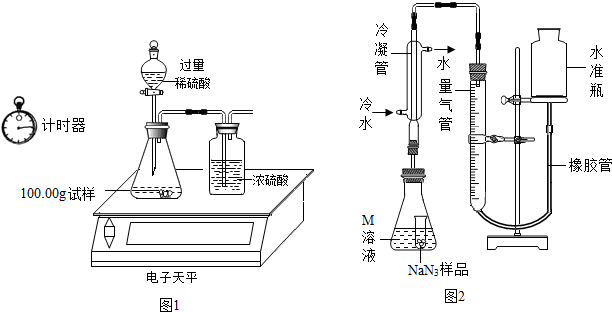
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
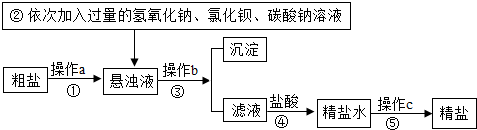
| A. | 操作a、b、c分别是溶解、过滤、降温结晶 | |
| B. | 步骤②中加入碳酸钠的目的是除去氯化钙杂质 | |
| C. | 操作b得到的沉淀中除泥沙外,共有三种物质 | |
| D. | 步骤④中,加入盐酸的目的是除去过量的氢氧化钠和碳酸钠,将滤液的pH调为7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com