
分析 反应前后的质量差即为反应生成氨气的质量,根据氨气的质量可以计算碳酸氢铵和生成的碳酸钠质量,进一步可以计算该化肥样品中氮元素的质量分数和所得溶液的溶质质量分数.
解答 解:(1)生成氨气质量为:8.5g+13.2g+20g-40g=1.7g,
答:生成了1.7g氨气.
(2)设碳酸氢铵质量为x,生成碳酸钠质量为y,
NH4HCO3+2NaOH═Na2CO3+2H2O+NH3↑,
79 106 17
x y 1.7g
$\frac{79}{x}$=$\frac{106}{y}$=$\frac{17}{1.7g}$,
x=7.9g,y=10.6g,
碳酸氢铵中氮元素质量为:7.9g×$\frac{14}{79}$×100%=1.4g,
该化肥样品中氮元素的质量分数:$\frac{1.4g}{8.5g}$×100%=16.5%,
答:该化肥样品中氮元素的质量分数16.5%.
(3)所得溶液的溶质质量分数为:$\frac{10.6g}{40g}$×100%=26.5%,
答:所得溶液的溶质质量分数为26.5%.
点评 差量法在计算中的应用很广泛,解答的关键是要分析出物质的质量差与要求的未知数之间的关系,再根据具体的数据求解.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
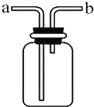 冷凝水回流,炸裂试管.
冷凝水回流,炸裂试管.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | Ⅰ | Ⅱ |
| 反应物 | 5%过氧化氢溶液 | 5%过氧化氢溶液 |
| 催化剂 | 1g 二氧化锰 | x g 氧化铜 |
| 时 间 | 46s | 84s |
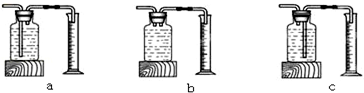
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
| Ⅰ | 50.0g | 1% | 0.1g | 9mL |
| Ⅱ | 50.0g | 2% | 0.1g | 16mL |
| Ⅲ | 50.0g | 4% | 0.1g | 31mL |
| 实验步骤 | 现 象 | 结 论 |
| 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有冷水的烧杯中 | 缓慢有少量气泡冒出 | 温度越高,过氧化氢分解的速率越快 |
| 取一支试管加入5mL 15%的过氧化氢溶液.然后把试管放入盛有热水的烧杯中 | 迅速有大量气泡冒出 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
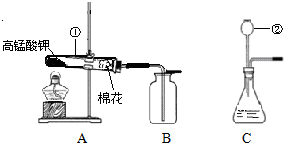
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com