
【题目】化学课堂围绕“酸碱中和反应”,将学生分成若干小组探究。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是:_________,该反应的化学反应基本类型是_____。
(查阅资料)CaCl2溶液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想 I:只有 CaCl2 猜想 II:有_____
猜想 III:有 CaCl2 和 Ca(OH)2 猜想 IV:有 CaCl2、HCl 和 Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想 IV 不合理,其理由是_____。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入 CO2 | 滴加 Na2CO3 溶液 |
实验操作 |
|
|
|
实验现象 | ______ | _____ | 产生白色沉淀 |
实验结论 | 溶液中含有:Ca(OH)2 | 溶液中含有:Ca(OH)2 | 溶液中含有:Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想 III 是正确的。
(评价反思)
(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因_____。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外.还需要考虑_____
【答案】Ca(OH)2+2HCl=CaCl2 +2H2O 复分解反应 CaCl2和HCl 稀盐酸和氢氧化钙不能共存 溶液变蓝色 产生白色沉淀 氯化钙和碳酸钠也能反应生成白色沉淀 反应物是否过量
【解析】
[演示实验]
将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中,稀盐酸和氢氧化钙反应生成氯化钙和水,该反应的化学方程式是:Ca(OH)2+2HCl=CaCl2 +2H2O,该反应是两种化合物交换成分生成另外两种化合物的反应,属于复分解反应。
故答案为:Ca(OH)2+2HCl=CaCl2 +2H2O、复分解反应;
[猜想与假设]反应后的溶液中,溶质有三种可能,一种是恰好完全反应,溶质只含有氯化钙。一种是酸过量,溶质是氯化钙和盐酸。一种是碱过量,溶质是氯化钙和氢氧化钙。乙组同学认为猜想Ⅳ不合理,因为稀盐酸和氢氧化钙不能共存。
故答案为:CaCl2和HCl、稀盐酸和氢氧化钙不能共存;
[实验探究]
氢氧化钙溶液显碱性,能使石蕊试液变蓝色。氢氧化钙能和二氧化碳反应生成碳酸钙沉淀和水。
故答案为:溶液变蓝色、产生白色沉淀;
[评价反思]
(1)氯化钙也能和碳酸钠反应生成碳酸钙沉淀和氯化钠,不能证明碱过量。故答案为:氯化钙和碳酸钠也能反应生成白色沉淀;
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还应该考虑反应物是否过量。
故答案为:反应物是否过量。


 天天练口算系列答案
天天练口算系列答案科目:初中化学 来源: 题型:
【题目】太阳能汽车利用太阳能来驱动,真正实现了零排放,有效地减少了对环境的污染,其产业的发展日益蓬勃。从某种意义上讲,太阳能汽车也是电动汽车的—种,所不同的是电动汽车的蓄电池靠工业电网充电,而太阳能汽车用的是太阳能电池。
(1)该太阳能汽车在白天给蓄电池充电的同时行驶,该行驶过程中首先_____能转化为化学能,然后转化为_____能,最终转化为机械能。
(2)该汽车车体主体材料是一种密度小、且抗腐蚀性好的一种合金,你认为下列材料中最合适的是_____(填字母)
A 玻璃钢 B 锰钢 C 硬铝 D 生铁
(3)目前还有一种新能源汽车,氢燃料电池汽车,该种汽车的储氢材料是循环吸放氢过程中生成新的氢化物,其中一种为氢化铝锂(LiAlH4)的氢化物,在125℃ 时分解为氢气和一种金属单质及氢化锂(LiH)。请你写出氢化铝锂分解反应的化学方程式①_____。反应前后铝元素的化合价分别为②_____。生活中使用的干电池中含有铅、镉、汞等,如果将废旧电池随意丢弃会③_____,威胁④_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜发明了“联合制碱法”,其生产过程中发生的反应主要是:其工业生产纯碱的工艺流程示意图如下所示,其中向粗盐水中加入的沉淀剂A、B分别为氧化钙和碳酸钠.
① NH3 + CO2 + H2O = NH4HCO3 ② NH4HCO3 + NaCl = NaHCO3↓ + NH4Cl ③ 2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
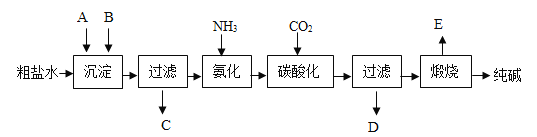
请回答下列问题:
(1)实验室提纯粗盐的实验操作依次为:取样、溶解、沉淀、过滤、蒸发结晶.若过滤时发现滤液中有少量浑浊,从实验操作的角度给出一种可能的原因:______.
(2)实验室中,用提纯得到的氯化钠配制100g 0.9%的生理盐水,使用的仪器除药匙、玻璃棒、托盘天平、胶头滴管、烧杯外,还需要适当的仪器是_________.
(3)生产纯碱的工艺流程中,碳酸化时析出NaHCO3晶体,没有析出Na2CO3晶体的原因是____。
(4)本工艺流程中氨(氨气)是循环使用的,为此,向滤液D中加入石灰水产生氨(氨气).写出该反应的化学方程式_________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“粗盐中难溶性杂质的去除实验中”,称取5.0 g粗盐,溶解后剩余1.0 g,经过过滤、蒸发得到3.0 g精 盐,下列有关该实验的说法错误的是
A.得到的精盐为混合物B.使用次数最多的仪器是玻璃棒
C.该实验得到的精盐产率为60%D.蒸发后,所得精盐潮湿,会导致产率偏高
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据图中A、B两种固体物质的溶解度曲线,回答下列问题.
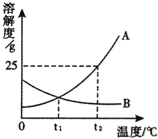
(1)在 ℃时,A、B两种物质溶解度相同.
(2)t2℃时,100g水中溶解_ gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为 ,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g.
(3)将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】生铁用途十分广泛。工业上利用赤铁矿(主要成分是 Fe2O3,还含少量 SiO2 等杂质)冶炼生铁的过程如下:

回答下列问题:
(1)生铁属于_______________材料(填“合成”或“金属”)。“高炉气体”中的_______________(填化学式)会导致酸雨。
(2)“煅烧”时:
①生成CO的反应之一为 ,该反应属于_______________(填基本反应类型)。
,该反应属于_______________(填基本反应类型)。
②用化学方程式表示利用 CO 炼铁的原理_____________________________________。
③CaCO3和SiO2固体在高温条件下发生反应,生成CO2气体和 CaSiO3,该反应的化学方程式为______________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将25克甲物质跟5克乙物质发生反应,所得混合物中有10克甲、11克丙,还有另一种新物质丁。若甲、乙、丙、丁的相对分子质量分别为30、20、44、18,化学式分别为A、B、C、D。则下列化学方程式中正确的是( )
A. A+B=C+D B. A+2B=2C+D
C. 2A+B=2C+D D. 2A+B=C+2D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是甲、乙两种固体物质的溶解度曲线,据此判断下列说法正确的是
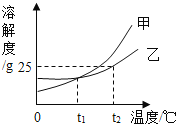
A.将乙的饱和溶液降温,不能析出晶体
B.t1℃时,甲、乙的溶解度相等
C.t2℃时,30 g 乙加到100 g水中能得到130 g溶液
D.升高温度,甲的不饱和溶液会变成饱和溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某超市卖的纯碱(Na2CO3)产品往往含有少量的氯化钠(NaCl),化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数。他们取20 g纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,共消耗盐酸100 g,烧杯中没有残留不溶物,称得反应后溶液的质量为113.4g。计算:(相对原子质量:Na:23 C:12 O:16)
(1)生成二氧化碳____g。
(2)样品中纯碱的质量分数是_______?(要求写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com