
【题目】元素周期律的发现对于寻找新材料、制备农药等具有重要作用。
(1)发现了元素周期律、制作出世界上第一张元素周期表的化学家是_____(填字母序号)。
A  门捷列夫 B
门捷列夫 B  达尔文 C
达尔文 C  牛顿
牛顿
(2)硅是重要的半导体材料。如图是元素周期表中硅元素的信息,由图可推知,硅原子的核外电子数为_____。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:初中化学 来源: 题型:
【题目】农历五月初五是我国的传统节日——端午节,食用粽子是中华民族的传统风俗。

(1)制作香菇鸡肉粽子的配料有:糯米、鸡肉、香菇、食用盐、植物油、白砂糖,其中富含糖类的是________。
(2)过量食用粽子会导致胃酸过多,可服用含有Al(OH)3的药物中和过量的胃酸,其化学方程式为______________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知,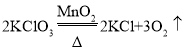 ,如图表示一定质量的
,如图表示一定质量的![]() 和
和![]() 固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是
固体混合物受热过程中,某变量y随时间的变化趋势,纵坐标表示的是
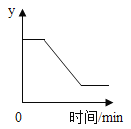
A. 固体中氧元素的质量B. 生成![]() 的质量
的质量
C. 固体中![]() 的质量D. 固体中钾元素的质量分数
的质量D. 固体中钾元素的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
(进行实验)装置图如下所示。

实验1:取饱和澄清石灰水进行实验。
实验序号 | 1-1 | 1-2 | 1-3 | 1-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
缓慢通入2 L空气后的浑浊程度 | 不明显 | 明显 | 非常明显 | 明显 |
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 | 2-1 | 2-2 | 2-3 | 2-4 |
饱和澄清石灰水体积/mL | 2.0 | 1.5 | 1.0 | 0.5 |
加入蒸馏水体积/mL | 0 | a | b | c |
缓慢通入3 L空气后的浑浊程度 | 非常明显 | 明显 | 不明显 | 无现象 |
(解释与结论)
(1)小试管中发生反应的化学方程式为____________。
(2)实验1的目的为____________。
(3)实验2中a、b、c三处数据,设计合理的是________。
A 0.5 0.5 0.5 B 0.5 1.0 1.5
C 1.0 1.5 2.0 D 1.0 2.0 3.0
(4)实验2的结论是________。
(反思与评价)
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是________,理由是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下提纯含少量泥沙的粗盐,一般经过以下操作流程:
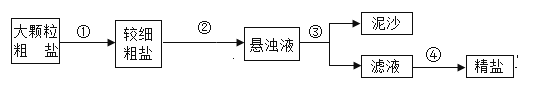
①整个过程中(除称量外)玻璃棒总共用到_______次,操作④中玻璃棒的作用是_______。
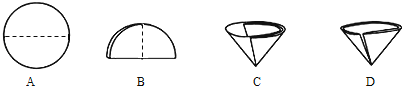
②操作③的名称是_______,这个过程需要将圆形滤纸折叠处理,如图中不该出现的情形是_______(填序号),粗盐提取过程中,称取一定量的粗盐后,决定溶解所需水的体积的主要因素是_______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制备二氧化碳并除去其中的杂质。
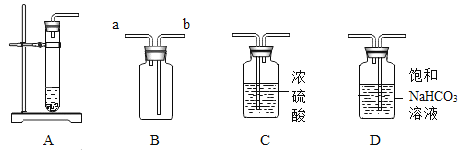
(1)利用装置A、B制取并收集二氧化碳。
① 制备二氧化碳的化学方程式为_____。
② 检验二氧化碳是否集满的操作是在a处放置_____。
(2)制得的二氧化碳中含有水蒸气、氯化氢等杂质气体。
① C中浓硫酸的作用是_____。
② D装置的作用是_____(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图象能正确反映对应变化关系是( )
A.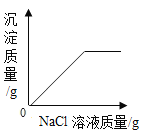 向一定质量的AgNO3溶液中滴加NaCl溶液
向一定质量的AgNO3溶液中滴加NaCl溶液
B.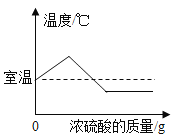 表示将浓硫酸加入水中
表示将浓硫酸加入水中
C.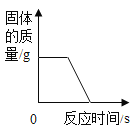 表示高温煅烧石灰石
表示高温煅烧石灰石
D.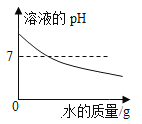 向氢氧化钠溶液中不断加水
向氢氧化钠溶液中不断加水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示为实验室中常见的气体的制备、干燥、净化、收集和性质实验的部分仪器,试根据题目要求回答下列问题:
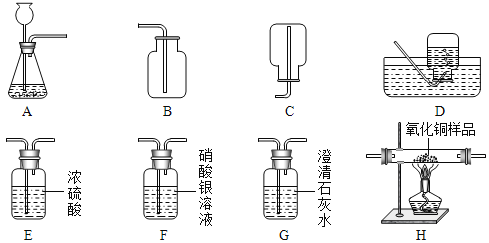
(1)用CaCO3固体和稀盐酸反应制取并收集干燥、纯净的二氧化碳.
①所选仪器的连接顺序为________________(填写仪器序号字母).
②生成二氧化碳时所发生反应的化学方程为____________________.
(2)小瑜同学欲用锌和稀硫酸反应制取氢气并用干燥的氢气测定某不纯氧化铜样品的纯度(杂质为单质铜),小瑜同学设计了实验方案,选择的装置按A→E1→H→E2→E3顺序连接,然后进行实验(H中发生反应的化学方程式为CuO+H2![]() Cu+H2O;E1、E2、E3为3个盛有浓硫酸的洗气瓶,假设试剂对气体的吸收均完全).
Cu+H2O;E1、E2、E3为3个盛有浓硫酸的洗气瓶,假设试剂对气体的吸收均完全).
①装置A中发生反应的化学方程式为_____________________________________.
②装置E1的作用是_____________________________.
③给氧化铜样品加热前,小瑜同学先向盛氧化铜样品的玻璃管中通入了一段时间的氢气.你认为他的操作是否正确,并说明理由____________________.
④小瑜通过测量反应前后E2装置的质量变化,来计算氧化铜样品的纯度.除此方法,你认为还可以通过测量来计算氧化铜样品纯度的方法是_________________.反应一段时间后先停止对玻璃管的加热并持续通入氢气至玻璃管冷却后,将被测样品取出,发现红色固体中存在少量黑色固体,则小瑜测得的氧化铜样品纯度与实际值比较将______(填“偏大”、“偏小”、“基本一致”之一).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com