解:(1)可令Fe
2O
3的系数为1,得到2FeS
2+
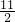
O
2→Fe
2O
3+4SO
2,再各项都乘以2,得4FeS
2+11O
2→2Fe
2O
3+8SO
2,
故答案为:4;11;2;8.
(2)酸性氧化物与碱反应生成盐和水,二氧化硫和二氧化碳的性质相似,
故答案为:S0
2+Ca(OH)
2═CaS0
3↓+H
20.
(3)比较酸性强弱,可根据酸的性质来分析,而本题要求用简单的方法,可用PH的大小比较来确定,PH越大,酸性越弱;
故答案为:选用PH试纸,分别测两溶液的PH,PH小的为硫酸,PH大的为碳酸,(或分别与碳酸钠反应,有气泡产生的是硫酸,无现象的是碳酸,或用紫色石蕊试液,根据颜色的深浅来区分).
(4)因二氧化硫不能使蔬菜生长,且有毒,遇水酸性较强,能使蔬菜死亡,
故答案为:枯萎(或死亡).
(5)稀释时要把密度大的加到密度小的液体中,
故答案为:将浓硫酸沿玻璃棒(或器壁)慢慢倒入水中,并用玻璃棒不断搅拌.
分析:本题考查工业生产硫酸中的有关知识.
(1)化学方程式的配平,可用待定系数法.
(2)利用酸性氧化物的性质来书写化学方程式.
(3)考查酸性强弱的比较,可利用PH的大小来分析.
(4)二氧化硫是空气污染物,不是蔬菜生长所需要的肥料.
(5)考查浓硫酸的稀释操作,注意密度大的加到密度小的液体中,并注意散热.
点评:本题考查的知识点多,借助工业生产为背景来考查化学知识,实际应用性强,体现化学在工业中的重要地位;此类习题将成为今后考题的方向.

 ______Fe2O3+______SO2
______Fe2O3+______SO2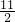 O2→Fe2O3+4SO2,再各项都乘以2,得4FeS2+11O2→2Fe2O3+8SO2,
O2→Fe2O3+4SO2,再各项都乘以2,得4FeS2+11O2→2Fe2O3+8SO2,

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案