
����Ŀ���Ͻ���������Ӧ��ʮ�ֹ㷺����֪ij�Ͻ��ĩ�������⣬����������ͭ�е�һ�ֻ����֣�С��������ͼװ�öԺϽ��ĩ������ͭ�Ĵ��ڽ���̽��ʱ���������������Һ����ϡ������뵽��ƿ�У�������ķ�������ɫ����ų���ע�������������ƶ���
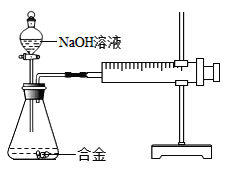
��������⣩�ѵ�NaOH��ҺҲ����ijЩ����������ѧ��Ӧ��
���������ϣ���1������������������Һ��Ӧ������ͭ����������������Һ��Ӧ��
��2����������������Һ��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O�T2NaAlO2+3H2����NaAlO2����ˮ����Һ����ɫ��
�����в��룩����1���úϽ��ĩ�г����⣬����������
����2���úϽ��ĩ�г����⣬������_____��
����3���úϽ��ĩ�г����⣬����������ͭ��
��ʵ��̽��������ʵ�飨����1������ѡ�õ��Լ���20%��������Һ��30%��NaOH��Һ��
��1ʵ���¼
ʵ�鲽�� | ʵ������ | ���� |
��ȡһ�����ĺϽ��ĩ���ӹ�����_____����ַ�Ӧ����ˣ��������� | ��ĩ�����ܽ⣬������ɫ����ų� | �Ͻ���һ������_____. |
��ȡ����������������ӹ���_____����ַ�Ӧ | ���������ܽ⣬������ɫ����ų�����Һ��dz��ɫ | �Ͻ���һ�����С�_____ |
���ó����ۣ�����3������
����˼��
һ����˵�����ý�������ϡ������ᷴӦ���������ᡢ��ܷ�Ӧ��˵����������������ʣ���С����Ͻ��ĩ�м������������ϡ���ᣬ������ʣ��Ĺ���ɷ���_____��
����չ��������������һ��ʵ�鷽�����Ƚ���������ͭ�Ľ������ǿ��_____��
���𰸡�ͭ NaOH��Һ �� ϡ���� ����ͭ ͭ ����������ͭƬ�ֱ������ͬŨ�ȵ�ϡ�����У�����������ϡ���ᷴӦ���������ɣ�����Ӧ�������ң�ͭ����ϡ���ᷴӦ���������ɣ�
��������
[����]�Ͻ��г��˺�����֮�⣬����������ͭ�е�һ�ֻ����֣�������еIJ����֪����ͭ��
[ʵ��̽��]������Ӧ����������������ͭ�����������ܽ���������壬����Һ��dz��ɫ��Ӧ��ͭ�������ᷴӦ�����������������Ƽ������Ĵ��ڣ�Ȼ���ٸ������ᷴӦʱ�������������ͭ�Ĵ��ڣ�
[��˼]�ڽ������˳���У�ͭ������ĺ��棬�����ᷴӦ��
[��չ�����]���ݽ���������Һ��Ӧ���������ڽ������˳���У�����ǰ��Ľ����ܰ����ں���Ľ�����������Һ���û������������û�������ͭ�����û��������������£�����������ͭƬ�ֱ������ͬŨ�ȵ�ϡ�����У�����������ϡ���ᷴӦ���������ɣ�����Ӧ�������ң�ͭ����ϡ���ᷴӦ���������ɣ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(Ti)����ʴ���ܺã�¶���ڿ��������꣬�Թ���������Խ��ʯ(��Ҫ�ɷ��� TiO2)Ϊԭ�����������ѵIJ�����Ҫ�У����ڸ����£�����ʯ�뽹̿�Ļ������ͨ������(Cl2)���õ�TiCl4��һ�ֿ�ȼ�����壻����ϡ�����廷���ͼ��������£���Mg��TiCl4��Ӧ�õ�Ti��MgCl2������˵������ȷ����(����)
A. ���еķ�ӦΪTiO2��C��2Cl2![]() TiCl4��CO2
TiCl4��CO2
B. ���е�ϡ������������Ǹ�������
C. ���з����ķ�ӦΪ�û���Ӧ
D. �������ڳ����²���O2��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ѧϰ�ᾧʱ��ͬѧ�Ƕ�����ص��Ʊ�����Ũ����Ȥ��
��һ��ͨ���������Ϸ����������ũҵ�г���;ʮ�ֹ㷺�����ڸ��Ϸʣ���ҵ�ϳ��������������Ȼ��ط�Ӧ�Ƶ�����غ��Ȼ��ƣ�NaNO3+KCl�TKNO3+NaCl������������غ��Ȼ����ڲ�ͬ�¶��µ��ܽ�Ȳ�ͬ�ɽ�����룬�������̿��Ա�ʾΪ��

��1���ܽ�ʱ��Ҫ���Ͻ��裬��Ŀ���� ��
��2����ѧʵ����������������IJ������������������ ��
��3������1����ʱҪ���ȹ��ˣ�Ŀ���� ��
��4����Һ1һ���� �ı�����Һ��
��5����ȴ�ᾧ���õ�����ؾ����л�����������NaCl��Ϊ��ø�������KNO3����Ӧ���еIJ�����ϴ�ӡ����ϴ����ѵ�ϴ�Ӽ�Ϊ ��
A�������µ�����ˮ B�����͵�NaCl��Һ C�����͵�KNO3��Һ
��6��ϴ�Ӻ��Һ��Ӧ�� ��
A����������ֱ���ŷŵ���ˮ��
B����������ֱ���ŷŵ�ũ��
C������ԭ�����Һ�У���Լ��Դ����߲���
������Ϊ�ⶨϴ��ǰ�Ĵֲ�Ʒ������ص������������������ʵ�飺ȡ5g�ֲ�Ʒ���50g��Һ��Ȼ������������������Һ����֪NaCl+AgNO3�TAgCl��+NaNO3������غ�����������Ӧ�������ݳ������������NaCl��������ȷ������ص�����������
��7����������Һ��Ҫ������ԭ���� ��֤���������ѹ����ķ����ǣ����ú����ϲ���Һ�м�����������Һ������۲쵽 �����л��ޣ��������ɣ����ѹ�����
��8����������������ȷ������£�����������Һ�����У����ӿ̶���ȡ����ˮ������������Һ�е�����ص��������� ����ƫ��ƫС����Ӱ�죩�������ⶨ�Ĵֲ�Ʒ������ص��������� ������ƫ��ƫС����Ӱ�죩
��9������ȷ�ⶨAgCl����������Ϊ1.435g������ôֲ�Ʒ������ص��������� ������д��������̣�������ʵ���Է���������NaCl 58.5��AgCl 143.5����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������W���ܽ�����ʵ�飬��ͼ��ʾ����صı�����ȫ��ȷ����
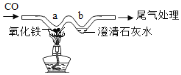
A. ʵ�鿪ʼ��ʱ����Ҫ��ͨһ�������
B. a�������������Ǻ���ɫ��������ĩ��Ϊ����ɫ
C. b���Ļ�ѧ��Ӧ����ʽΪ Ca(OH)2+CO2=CaCO3 +H2O
D. ��װ�õ��ŵ��ǽ�ԼҩƷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ߴ�̼���̣�MnCO3���й㷺����;�����ù�ҵ�������Ʊ���������:
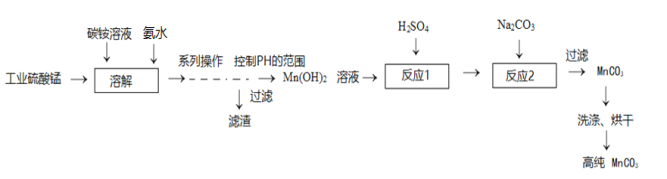
��֪��MnCO3������ˮ���Ҵ�����ʪʱ�ױ�����������100����ʼ�ֽ⣻Mn(OH)2��ʼ������pH=7.7��
��1��ϵ�в�����������pH�ķ�Χ_____�������������7.7��
��2����Ӧ1����������Ӧ�����е�_____�������û���Ӧ�����кͷ�Ӧ�������ֽⷴӦ������
��3��д����Ӧ2�Ļ�ѧ����ʽ_____��ϴ�Ӽ����ѡ���Ҵ���ԭ��_____�������_____������������ڣ���100��C������н��С�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ռ���һЩ����Ϊ FeSO4 �� CuSO4 �ķ�Һ�����л��ս���ͭ������������Һ����������·�����
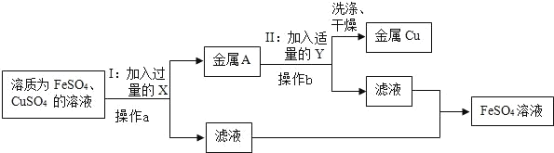
�ٲ��� I ���йط�Ӧ�Ļ�ѧ����ʽ�� ___��
�ڲ��� II �������Լ� Y �������� ___��
�ۼ������ X ��Ŀ���� ___��
�ܲ��� a �� b �������� ___������Ҫ����Ҫ�����������ձ���©���� ___��
���������� ___��ѡ����ţ��������ķ�Ӧ�������Ļ�Ա�ͭǿ��
���� II �о���ϴ�ӡ�������Եõ������Ľ���ͭ��ϴ��ʱ�������ͭ�Ƿ���ϴ���ķ����� ___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ZnSO4 ������Һ�����������������¶ȱ仯��������ͼ��ʾ��˵����ȷ����
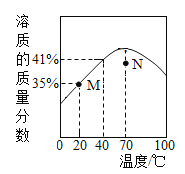
A. M ���Ӧ�� ZnSO4 ��Һ�Dz�������Һ
B. N ���Ӧ�� ZnSO4 ��Һ���»��¾���������������
C. ZnSO4 ������Һ�����������������¶����߶�����
D. 40��ʱ��ZnSO4 ���ܽ��Ϊ 41g/100g ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����д��ѧ���Ż����ƣ�
A �����dz�˵���߿�ȱ�����е�����_____������ţ�������������Ԫ����+3��_____��2H_____��2Mg2+_____��
B�� Ԫ�ط��ŵIJ�ͬ���о��в�ͬ�ĺ��壬��д������������ȱ�ٵ�Ԫ�ط��š�
O Si_____Fe Ca��C N O_____ Ne��
C�� ԭ�����ڻ�ѧʽ��д�о��зdz���Ҫ�ĵ�λ�����DZ����������յ��������Ҫ��ԭ���ţ����ӣ�
NH4+ OH��_____ SO42�� CO32��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij��ѧ��Ӧ����ʾ��ͼ������������ȷ���ǣ��� ��
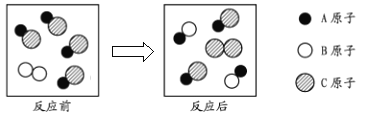
A. ij������ij������֮��Ļ��Ϸ�ӦB. ij����������һ������֮�临�ֽⷴӦ
C. ij������ij������֮����û���ӦD. û�з�����ѧ��Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com