
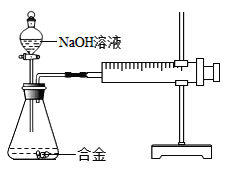
����Ŀ��ʵ�������ռ���һЩ����Ϊ FeSO4 �� CuSO4 �ķ�Һ�����л��ս���ͭ������������Һ����������·�����
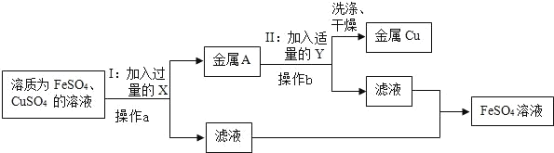
�ٲ��� I ���йط�Ӧ�Ļ�ѧ����ʽ�� ___��
�ڲ��� II �������Լ� Y �������� ___��
�ۼ������ X ��Ŀ���� ___��
�ܲ��� a �� b �������� ___������Ҫ����Ҫ�����������ձ���©���� ___��
���������� ___��ѡ����ţ��������ķ�Ӧ�������Ļ�Ա�ͭǿ��
���� II �о���ϴ�ӡ�������Եõ������Ľ���ͭ��ϴ��ʱ�������ͭ�Ƿ���ϴ���ķ����� ___
���𰸡�Fe+CuSO4��FeSO4+Cu ϡ���� ʹ CuSO4 ��ȫת��Ϊ FeSO4 ���ˣ� ������ I ȡ���ϴ��Һ�������μ������Ȼ�����Һ�������ᱵ��Һ������������Һ������������������֤������ͭ��ϴ��
��������
��������Ҫ��ͭ����ת��Ϊͭ���ʣ�����Һ������Ϊ���������������������µ����ʣ����Կ��Լ����X������ͭ����ת��Ϊͭ���ʣ���Ӧ�Ļ�ѧ����ʽ�ǣ�Fe+CuSO4�TCu+FeSO4��
�������м��������������Ҫ�õ��������������Բ��ۢ��������Լ�Y��������ϡ���
�ۼ������X��Ŀ���ǽ�����ͭ��ȫ��Ӧ��
�ܲ���a��b�ܽ���Һ�ֿ��������ǹ��ˣ�����Ҫ����Ҫ�����������ձ���©���Ͳ�������
�ݲ�����������ķ�Ӧ���ܽ�ͭ��������Һ���û��������������Ļ�Ա�ͭǿ��
������о���ϴ�ӡ�������Եõ������Ľ���ͭ��ϴ��ʱ�������ͭ�Ƿ���ϴ���ķ�����ȡ���ϴ��Һ�������μ������Ȼ�����Һ�������ᱵ��Һ������������Һ������������������֤������ͭ��ϴ����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨ������������Ϊ32%�������ʵ������������С��ʵ��ʱ�����ձ��м���20 g 40%������������Һ������μ�������ᣬ�ⶨ������������������ձ�����ҺpH�Ĺ�ϵ��ͼ��
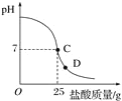
(1)��������������Һ�����ʵ�����Ϊ_____g��
(2)�����濴����ͼ��Ϣ��ش��������⡣
�ٵ��μ����ᵽC��ʱ�������ĵ����������ʵ������Ƕ��٣�_____��
�ڸ������ʵ�����������Ƕ��٣�(������0.1%)_____��
�۵���������Һ���������������ı��ԭ����_____��
�ܵ��μ����ᵽͼ����D��ʱ���ձ�����Һ��������_____(�ѧʽ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���õ�ⱥ��NaCl��Һ�ķ�������ȡNaOH��Cl2��H2����������Ϊԭ������һ
ϵ�л�����Ʒ����Ϊ�ȼҵ���ڹ�ҵ�ϣ���ȡ�������ռ�����Ҫ�����������£�

�����������ú�ˮ��ȡ���εĹ�������ͼ����

��1��ͼ�Т��� �������������ȴ��������
��2��ĸҺΪ�Ȼ��Ƶ� ������͡������͡�����Һ��
��������������ҵ�ϴ��Σ���MgCl2��CaCl2��Na2SO4�����ʣ������Ȼ��ƣ�������������ͼ����

��1��X���������� ��
��2��д�����ɳ���D��һ����ѧ����ʽ ��
��3����ҺE�мӹ���ϡ����������� ��
��4��ʵ�����þ��ε��������ڴ�����NaCl��������ԭ���� ��
����������ⱥ��ʳ��ˮ�����������ռ�ⶨ�ռ�Ĵ��ȡ�
��1����д��������������������Ӧ�Ļ�ѧ����ʽ ��
��2����ҵ�ռ������һ�����Ȼ��ƺ�̼�������ʡ�Ϊ�˲ⶨ�ռ�ĺ�����С��ͬѧ���̽�����������ʵ�鲢���������ͼ��

������С��ͬѧ��õ����ݼ����ռ���Ʒ���������Ƶ��������������г�������̣� ��
��3��Сǿͬѧ��ΪС��ͬѧ��Ƶ�̽�������������ܣ�����������
��̽��������û�����������Ƶ���ˮ����
��̽����������ȱ�� ����������ƣ������²�õ��������Ƶ���������ƫС��
��������Ӧ�þ���
����������������Һ��Ӧ�Ļ�ѧ����ʽΪ��Cl2+2NaOH=NaCl+NaClO+H2O����ҵ����������ʯ����[Ca(OH)2]��Ӧ����ȡƯ�ۣ��йط�Ӧ�Ļ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ�ش����⣺
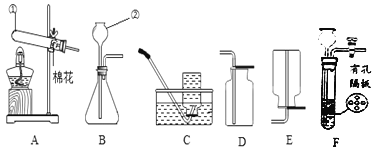
��1��д���б�ŵ��������ƣ��� ���� ��
��2��ʵ�����ø��������ȡO2�Ļ�ѧ����ʽΪ ����A��Dװ����ȡO2ʱ��Ϊ��ֹ������ؽ��뵼�ܣ��ɲ�ȡ�Ĵ�ʩ�� ��
��3��ʵ������B��Cװ����ȡCO2�Ļ�ѧ����ʽΪ ����������װ����B��ΪF�����ŵ��� ��
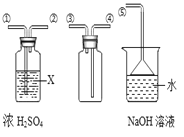
��4��SO2����ɫ�д̼�����ζ���ж����壬�ܶȱȿ�����������ˮ��SO2��ijЩ��ѧ������CO2���ƣ�ʵ���г���NaOH��Һ����SO2β��������ͼ��ʾװ���ռ�һƿ�����SO2��װ���е��ܰ�������������˳���Ǣ١��ڡ� �� ���ݣ�����ţ���ͼ��©���������� ���ձ���NaOH��Һ�� ���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ͻ���������Ӧ��ʮ�ֹ㷺����֪ij�Ͻ��ĩ�������⣬����������ͭ�е�һ�ֻ����֣�С��������ͼװ�öԺϽ��ĩ������ͭ�Ĵ��ڽ���̽��ʱ���������������Һ����ϡ������뵽��ƿ�У�������ķ�������ɫ����ų���ע�������������ƶ���
��������⣩�ѵ�NaOH��ҺҲ����ijЩ����������ѧ��Ӧ��
���������ϣ���1������������������Һ��Ӧ������ͭ����������������Һ��Ӧ��
��2����������������Һ��Ӧ�Ļ�ѧ����ʽΪ��2Al+2NaOH+2H2O�T2NaAlO2+3H2����NaAlO2����ˮ����Һ����ɫ��
�����в��룩����1���úϽ��ĩ�г����⣬����������
����2���úϽ��ĩ�г����⣬������_____��
����3���úϽ��ĩ�г����⣬����������ͭ��
��ʵ��̽��������ʵ�飨����1������ѡ�õ��Լ���20%��������Һ��30%��NaOH��Һ��
��1ʵ���¼
ʵ�鲽�� | ʵ������ | ���� |
��ȡһ�����ĺϽ��ĩ���ӹ�����_____����ַ�Ӧ����ˣ��������� | ��ĩ�����ܽ⣬������ɫ����ų� | �Ͻ���һ������_____. |
��ȡ����������������ӹ���_____����ַ�Ӧ | ���������ܽ⣬������ɫ����ų�����Һ��dz��ɫ | �Ͻ���һ�����С�_____ |
���ó����ۣ�����3������
����˼��
һ����˵�����ý�������ϡ������ᷴӦ���������ᡢ��ܷ�Ӧ��˵����������������ʣ���С����Ͻ��ĩ�м������������ϡ���ᣬ������ʣ��Ĺ���ɷ���_____��
����չ��������������һ��ʵ�鷽�����Ƚ���������ͭ�Ľ������ǿ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������ռ���һЩ����Ϊ FeSO4 �� CuSO4 �ķ�Һ�����л��ս���ͭ������������Һ����������·�����
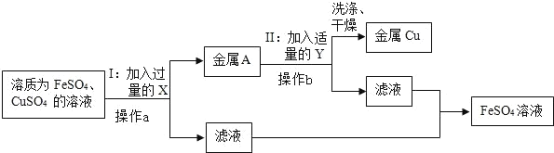
�ٲ��� I ���йط�Ӧ�Ļ�ѧ����ʽ�� ___��
�ڲ��� II �������Լ� Y �������� ___��
�ۼ������ X ��Ŀ���� ___��
�ܲ��� a �� b �������� ___������Ҫ����Ҫ�����������ձ���©���� ___��
���������� ___��ѡ����ţ��������ķ�Ӧ�������Ļ�Ա�ͭǿ��
���� II �о���ϴ�ӡ�������Եõ������Ľ���ͭ��ϴ��ʱ�������ͭ�Ƿ���ϴ���ķ����� ___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���NaCl��KNO3�ڲ�ͬ�¶�ʱ���ܽ�ȣ��������ݻش�
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ�� | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
��g/100gˮ�� | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 |
���Ȼ��Ƶ��ܽ�����¶ȱ仯��Ӱ��_____����ܴ�С������
��50��ʱ��KNO3���ܽ��_____���������������������NaCl���ܽ�ȣ����ձ��м���100gˮ��49.0gKNO3�������50�����Һ������ȴ��20�棬�ձ����������������Ϊ_____g��
��KNO3�л���������NaCl���ᴿ�ķ�����_____������½ᾧ���������ᾧ������
��Ҫ�Ƚ�NaCl��KNO3��ˮ�е��ܽ���ǿ�����ⶨ�����ݿ����ǣ���ͬ�¶��£���������������ȫ�ܽ�ﵽ����ʱ����ˮ����������_____��
����ͼ���й��������Һ��ʵ��������仯�����˵����ȷ����_____�����ţ���
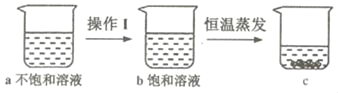
A ����Iһ���ǽ���
B a��b���ܼ������������
C a��c����������һ�����
D b��c��������������һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ģ������ϵ������۵���������ͼ������Ӻ��������˶���ʾ��ͼ������˵������ȷ����
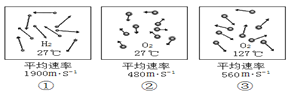
A. �ɢ٢ڢۿ�֪��֮���п�϶
B. �ɢ٢ڢۿ�֪���ڲ�ͣ���˶�
C. �ɢ٢ڿ�֪�����˶��ٶ������ʱ��������й�
D. �ɢ٢ۿ�֪�����˶��ٶ����¶��й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ�Ľ������ǻ�ѧʵ�����г�����ҩƷ���仯ѧ����ʮ�ֻ��á�ij��ѧ��ȤС���ͬѧ����������̽�����
[��������]
��һС������ɫ�Ľ����Ʒ����ڿ����лᷢ�����б仯��
��![]() �Ƶ�������
�Ƶ�������![]() ����������Һ
����������Һ![]() ��ɫ����
��ɫ����
[��������]
A.�Ƶ��������������ƣ�Na2O���������ƣ�Na2O2����������ˮ��Ӧ����Ӧ��ѧ����ʽ
��:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2��
B.CaCl2��Һ�����ԣ�̼������Һ����CaCl2��Һ�������ֽⷴӦ��
C.̼������Һ�����ᷴӦ����ʽ�У�
Na2CO3 +HCl=NaHCO3 +NaCl�����������㣩
Na2CO3+2HCl=2NaCl+H2O+CO2����������������
̽��һ���Ƶ���������Na2O����Na2O2 ?
��1��Ϊ���鳣��������������Ӧ�IJ����Na2O����Na2O2�����ʵ�鷽����
ѡȡ�Լ� | ʵ������ | ʵ����� |
__________ | __________ | ����ΪNa2O |
̽��������ɫ������NaOH����Na2CO3 ?
��2�� ���ڿ����з���һ��ʱ��õ���ɫ����ijɷ�
����1��Na2CO3 ����2��NaOH ����3��Na2CO3��NaOH
[ʵ��1] ȡ������ɫ�����ˮ�����Һ���ٵ��뼸��ϡ���ᣬ�����ݲ�����
��ѧС����Ϊ���ݴ��������ܵó�����2������������________________��
[ʵ��2] ��ѧС���������ʵ��
ʵ����� | ʵ������ | ʵ����� |
��ȡ������ɫ���������Һ����������______ | __________ | ����3���� |
�����ˣ�ȡ������Һ����___________ | __________ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com