
【题目】莽草酸(C7H10O5)是从八角中提取的一种化合物,是合成治疗新冠肺炎的药物“奥司他韦”的原料。计算:
(1)莽草酸中共含有 种元素(写数字)。
(2)莽草酸的相对分子质量是 。
(3)莽草酸中氧元素的质量分数为 (结果精确到0.1%)。
(4)若莽草酸中含有4g氧元素,则莽草酸的质量为 g(结果精确到0.1)。
 通城学典默写能手系列答案
通城学典默写能手系列答案科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
农药在农业生产中发挥着至关重要的作用,可以有效地防控农作物病虫害。但某些地区确实出现过农药残留超标事件,让一些人“谈药色变”。怎样科学地减少果蔬中的农药残留呢?有些农药随着温度的升高,分解会加快。通过在沸水中焯或使用蒸、炒等烹饪手段可以去除蔬菜中氨基甲酸酯类农药的残留。部分农药在空气中能够缓慢地分解为对人体无害的物质。所以对一些易于保存的农产品,如胡萝卜、南瓜、土豆等,可以在室外存放一定时间来减少农药残留量。有科研人员监测了番茄中三唑酮(C14H16ClN3O2)在温室大棚内和室外的分解规律,如图。
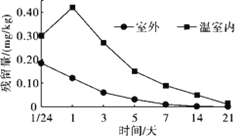
去皮可以有效减少果蔬中的农药残留。但部分果蔬不容易去皮,如生菜、草莓、樱桃等,因此清洗成为了消费者去除农药残留的重要方式。由于大多数农药难溶于水,可利用洗菜机或加入洗涤盐等方式提高农药残留的去除效果,有人研究了利用不同方法去除黄瓜中嘧菌酯农药残留的效果,如图所示。
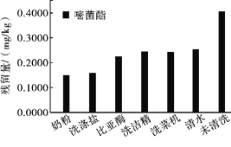
可见,减少农药残留的关键是认识物质的性质。基于农药的不同性质,采用有针对性的方法来去除。
依据文章内容回答下列问题。
(1)在沸水中焯蔬菜可以去除氨基甲酸酯类杀虫剂的残留,这是利用了氨基甲酸酯类的_______(填“物理”或“化学”)性质。
(2)三唑酮C14H16ClN3O2由_______种元素组成。
(3)依据图,影响番茄中三唑酮残留量的因素有________。
(4)为了最大量地去除黄瓜中的嘧菌酯,在清洗黄瓜时,应采用的方法是________。
(5)下列说法合理的是_________(填字母序号)。
A.为了防止农药在农产品中残留,必须全面禁止使用农药
B.采摘瓜果后,建议清洗干净再食用
C.削去果皮,也能减少农药残留
D.利用农药的某些物理和化学性质可以有效地减少农药残留量
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列装置回答有关问题:
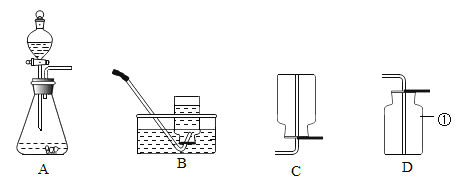
(1)仪器①的名称是_______。
(2)若要制取并收集较纯净的氧气,可从图中选择的装置组合是_____(填字母) ;组装完气体发生装置后,应先____,再添加药品。
(3)装置D收集CO2时,用_____检验气体是否集满。
(4)实验室用锌粒和稀硫酸制取氢气,__(填“能”或“不能”)选择A为发生装置。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】人体中的钙元素主要存在于骨骼和牙齿中,以羟基磷酸钙晶体(Ca10(PO4)6(OH)2)形式存在,其相对分子质量为1004,牛奶含钙丰富又易吸收,且牛奶中钙和磷比例合适,是健骨的理想食品。如图是某品牌纯牛奶包装上的部分文字说明,请认真阅读后回答下列问题:

(1)牛奶中富含的营养素为 (填一种即可)。
(2)Ca10(PO4)6(OH)2由 种元素组成。
(3)一盒牛奶含钙至少多少g?(精确到0.01)
(4)若人体每天至少需要0.6g钙,而这些钙有90%来自牛奶,则一个人每天要喝多少盒牛奶?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶解是生活中的常见现象。
(1)A、B、C三种物质的溶解度曲线如图所示。
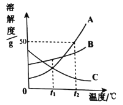
①t1℃时,______两种物质的饱和溶液中溶质质量分数相等。
②t2℃时,把60gA放入100g水中,充分搅拌得到A的溶液溶质和溶液的质量比为_____(填最简比)。
③将t2℃的A、B、C三种物质的饱和溶液都降温至t1℃,所得三种溶液的溶质质量分数由大到小关系是_______。
(2)下表是氯化钠和硝酸钾两种物质在不同温度时的溶解度,根据表中信息回答问题。
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
硝酸钾 | 13.3 | 31.6 | 63.9 | 11. | 169 | 246 | |
①40℃时,硝酸钾的溶解度________氯化钠的溶解度(填“>”“=”或“<”)。
②取100mL水,加入30g氯化钠,充分搅拌,恢复至20°C,得溶液A,A溶液属于_______溶液(填“饱和”或“不饱和”);加热A溶液至60°C,再加10g氯化钠,搅拌,得溶液B。B溶液质量是_______g。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示是实验室制取气体的常用装置。请回答下列问题。
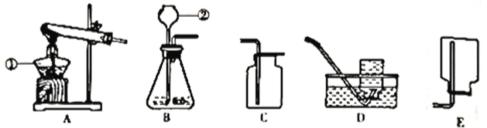
(1)A装置中仪器①的名称是______试管口略向下 倾斜的原因是___________ 。
(2)仪器②的名称是___ 该仪器的主要 作用是______________ 。
(3)实验室用加热氧酸钾制取氧气,应选择的发生装置为_______(填字母序号);若要收集较纯净的氧气,应选择的收集装置是_________ ( 填字每序号)。写出过氧化氢溶液和二氧化锰的混合物制取氧气的化学方程式___________________________ 。
(4)制取氧气和二氧化碳均可选择的发生装置和收集装置为_____________ ( 填字母序号)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上冶炼金属锌主要有火法和湿法两种工艺。
(1)火法炼锌时发生如下反应:
2ZnS+3O2 2ZnO+2SO2;2C+O2
2ZnO+2SO2;2C+O2 2CO;ZnO+CO
2CO;ZnO+CO Zn+CO2。
Zn+CO2。
①化合物ZnS中Zn元素的化合价是_____,上述反应在鼓风炉中控制温度在1100℃至1300℃进行,使生成的锌气化蒸馏出来,蒸馏过程属于_____变化。
②已知反应前矿石中ZnS的质量为ag,则理论上可以生成Zn的质量为_____g(用含a的式子表示,可不化简)。
(2)湿法炼锌的原理是利用CO32-与Zn2+结合生成ZnCO3沉淀。某研究小组利用该原理,用碳酸钠作为沉淀剂,探究从含锌废水中回收锌的最佳条件,实验的数据如下:
实验编号 | 初步处理的废液用量/mL | pH值 | 反应时间/min | 沉锌率% |
a | 800 | 6 | 30 | 84.30 |
b | 800 | 7.5 | 10 | 85.27 |
c | 800 | 7.5 | 30 | 99.60 |
d | 800 | 8.0 | 30 | 99.55 |
①本实验探究了哪些因素对沉锌率的影响_____。
②已知碳酸钠溶液呈碱性。实验中碳酸钠使用量最大的是_____(填编号)。工业生产中采用实验_____(填编号)的提取条件更合理。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是( )
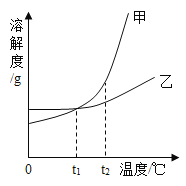
A.甲、乙的溶解度相等
B.要从含有少量乙的甲溶液中得到较多的甲,通常可采用蒸发结晶的方法
C.等质量的甲、乙分别配成t2℃时的饱和溶液,需要水的质量:甲小于乙
D.t1℃时,甲、乙的饱和溶液升温到t2℃后,溶质质量分数相等
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,我们应该了解水的净化和水资源的保护。
(1)自来水净化时常用沉淀、过滤、_____、消毒等净化方法。
(2)“节约用水,从我做起”。请你任举一例生活中节约用水的做法_____。
(3)甲、乙两种固体物质溶解度曲线如图所示:
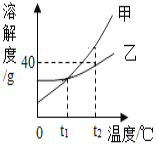
①甲和乙的溶解度相等时温度为_____。
②t2℃时,等质量的甲、乙饱和溶液,降温到tl℃,甲和乙两种溶液中析出晶体的质量关系为甲_____乙(填“大于”“小于”或“等于”)。
③t2℃时,用70g乙的饱和溶液,加水_____g可以稀释成20%的乙溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com