
【题目】纯碱在工业上有广泛的应用。实验室模拟工业上利用饱和食盐水生产纯碱的流程图是:
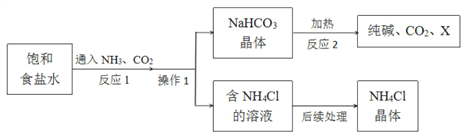
回答下列问题:
(1)反应 1 的化学方程式为________________________________________。
(2)操作 1 中,需要用到的玻璃仪器除漏斗、玻璃棒外,还有______________。
(3)纯碱的化学式为_________,X的化学式为________。
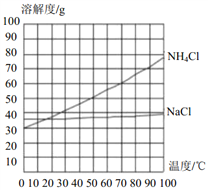
(4)“后续处理”主要包括蒸发浓缩、_________、过滤等操作,参考如图的溶解度曲线分析,采用这些操作方法的原因是___________________________。
(5)写出 NH4Cl 的一种用途_____。
【答案】 NaCl + NH3 + CO2 + H2O == NaHCO3↓ + NH4Cl 烧杯 Na2CO3 H2O 降温结晶 NH4Cl的溶解度随温度的降低而减小 用作氮肥
【解析】(1). 氨气、水】二氧化碳7氯化钠四种物质反应生成碳酸氢钠和氯化铵,方程式为:NaCl + NH3 + CO2 + H2O == NaHCO3↓ + NH4Cl (2). 过滤操作需要的玻璃仪器除漏斗、玻璃棒外,还有烧杯 (3). 碳酸钠俗称纯碱,化学式为Na2CO3 (4). 由反应方程式可知X是H2O (5). 由溶解度曲线图可知,NH4Cl的溶解度随温度的降低而减小 ,而氯化钠的溶解度受温度很小,降温时氯化铵大部分析出,而氯化钠不析出,所以可用降温结晶 提纯氯化铵; (7). 氯化铵含有氮元素,可用作氮肥


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:初中化学 来源: 题型:
【题目】将30g 碳酸钠溶液与48.2g氯化钡溶液混合,碳酸钠和氯化钡两种物质恰好完全反应。过滤,所得滤液质量为58.5g,试计算:
⑴反应后生成的沉淀质量为 克.
⑵所得滤液中溶质的质量分数为多少?(用百分数表示,写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
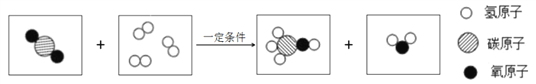
【题目】在点燃条件下,A和B反应生成C和D,反应前后分子种类变化的微观示意图如所示:

请回答以下问题:
(1)4种物质中,属于化合物的是______________(填图中字母)。
(2)写出该反应的化学方程式为:__________________,该反应的基本类型______。
(3)求出物质A中氮元素的质量分数____________________(结果保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某学习小组欲从高锰酸钾制氧气剩余物中回收副产物,设计了如图所示实验方案:
【资料卡片】
①KMnO4能和纤维素反应。,在中性溶液中比较稳定,加热碱性条件中的KMnO4溶液会有部分KMnO4和H2O反应,生成MnO2;
②锰酸钾溶于水为墨绿色,不稳定,在水溶液中能全部转化为KMnO4、MnO2和KOH,反应的化学方程式如下:3K2MnO4+2H2O==2KMnO4和+MnO2↓+4KOH
【实验方案】

(1)将剩余物加入水中,观察到的现象是:①部分固体溶解;②有少量不溶物出现;③____________。
(2)回收物甲是____________________(填化学式)。
(3)静置后过滤时,发现滤液浑浊,在操作均正确的情况下(过滤前滤纸完好无损),原因是_______。
(4)滤液B中一定含有的溶质是KMnO4和_______________,需要加入少量硫酸进行中和,中和反应的化学方程式是____________________________________。
(5)冷却结晶后,低温烘干高锰酸钾晶体是为了防止_____________________。
(6)加热31.6gKMnO4使之完全分解,按以上实验方案可得回收物甲的质量可能是________。
A.8.7g B.11.5g C.12.8g D.28.4g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的有机化工原料,在化工、医药及运输等行业都有广泛的应用。以下是制得甲醇的化学反应的微观示意图:
请回答:
(1)![]() 表示的微粒是____________(填名称)。
表示的微粒是____________(填名称)。
(2)以上反应中,属于单质的物质的化学式是______________。
(3) 以上反应的化学方程式为___________________________________________。
(4)上图所示反应说明化学反应前后发生改变的微粒是_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A、B、C、D四种物质在一定条件下有如下转化关系(所有物质均已给出),则下列有关说法中,不正确的是

A. 若A、C的组成元素相同,则D是一种单质
B. 若B是酸,则C是水
C. 若B是碱,则C是水
D. A、B、C、D四种物质中可能有两种碱
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2016年诺贝尔化学奖授予了在“分子机器”的设计和合成方面作出了杰出贡献的科学家。下列物质中,由分子直接构成的是(____)
A.金刚石 B.氢气 C.硫酸铜 D._________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,某研究性学习小组模拟生产企业制取氢化钙。
【查阅资料】
I、白色的无水硫酸铜粉末吸水后会变蓝;
Ⅱ、碱石灰是氧化钙和氢氧化钠的混合物;
Ⅲ、钙、氢化钙遇水立即发生剧烈反应:Ca+2H2O=Ca(OH)2+H2↑;CaH2+2H2O=Ca(OH)2+2H2↑;
Ⅳ、钙能燃烧生成氧化钙;氢化钙能燃烧生成氧化钙和水。
【实验原理】
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)同学们设计了以下实验装置:
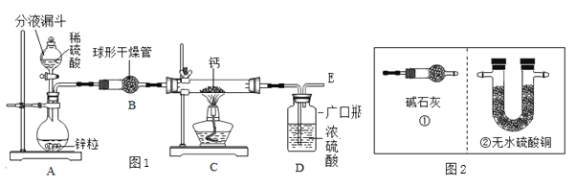
请回答:
①装置A中发生反应的化学方程式为____________________;为了实验安全,点燃C装置酒精灯前应先__________________;
②上图1装置B中装有无水氯化钙,其作用是干燥H2,若要证明进入C装置中的氢气已经干燥,在B、C之间应连接图2中的__________(选填:①或②)装置;
③图1装置D中浓硫酸的作用是__________________;
【进行实验)过程略
【验证产物】略
【实验拓展】(2)定性实验用化学方法鉴别Ca与Ca比,完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,在干燥条件下与氧气反应,将其产物通入装有无水硫酸铜的干燥管; | ___________________ |
(3)定量实验:测定Ca和CaH2混合物中CaH2的质量分数。
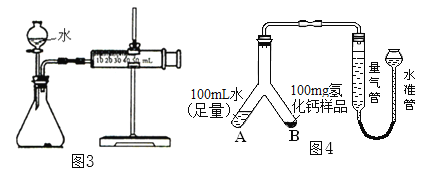
①取m1g样品与水完全反应,利用如图3装置测定生成的气体体积时,在_______时进行收集(选填字母);
a.刚开始有气泡时 b.气泡连续均匀冒出时 C.气体经过验纯
②按图3实验装置进行测定时,甲同学发现,即使气密性良好,操作正确,测得的气体体积还是偏大,可能原因是___________________;(写出任一点即可)
③乙同学将实验装置改进为如图4(固定装置省略)所示,调整水准管高度,使量气装置两边的液面保持在同一水平面上,读取量气管中液面所示刻度为10.0mL。将Y形管慢慢倾斜,直至A中的水全部倒入B中,与样品混合反应,待反应结束后,冷却至室温,再次调节量气管与水准管液面相平,读取量气管中液面所示刻度为98.9mL。已知该实验条件下,氢气的密度为0.09mg/mL。样品中氢化钙的质量分数为_______________;(结果精确到0.1%)
【反思与交流】
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?
你的观点是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一些企业用皮革废料熬制工业明胶,在加工过程中添加重铬酸钾(化学式为K2Cr2O7)。在加热条件下重铬酸钾会分解,反应的化学方程式为:4K2Cr2O7![]() 4K2CrO4+2X+3O2↑。若使用工业明胶制造药用胶囊,会导致胶囊铬超标。铬是一种重金属元素,能对肝、肾等内脏器官和DNA造成损伤。在通常情况下,铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;在加热时,能与浓硫酸反应生成硫酸铬(其中铬元素化合价为+3价),同时还生成一种大气污染物和一种常见的液体。
4K2CrO4+2X+3O2↑。若使用工业明胶制造药用胶囊,会导致胶囊铬超标。铬是一种重金属元素,能对肝、肾等内脏器官和DNA造成损伤。在通常情况下,铬单质是银白色有金属光泽的固体,有较高的熔点,是最硬的金属;在加热时,能与浓硫酸反应生成硫酸铬(其中铬元素化合价为+3价),同时还生成一种大气污染物和一种常见的液体。
试根据材料回答下列问题:
(1)重铬酸钾(K2Cr2O7)中铬元素的化合价是________;K2Cr2O7分解生成X的化学式为______________;
(2)说出铬单质的一条物理性质___________________________________;
(3)硫酸铬中铬、硫、氧三种元素的质量比为__________________填最简整数比)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com