
【题目】某化学实验小组同学测量氢化钙(CaH2)样品中氢化钙的质量分数。取5g样品于锥形瓶中,加入100g水溶解,待样品不再溶解时,称得锥形瓶剩余物质的质量为104.8g(假设杂质与水不发生反应,CaH2+2H20=Ca(OH)2+2H2↑),请回答下列问题:
(1)反应生成的氢气质量为_______________。
(2)计算样品中氢化钙的质量分数____________。
科目:初中化学 来源: 题型:
【题目】工业上将氢气与氯气(Cl2)在点燃的条件下反应生成氯化氢(HCl),用水吸收氯化氢制盐酸.氢气在氯气中燃烧的化学方程式为______________________,反应的基本类型是_________________.向滴有酚酞的氢氧化钠溶液中滴加稀盐酸.溶液由红色变成无色,该反应的化学方程式为__________________________________________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通过一年的化学学习,相信你已经掌握了一些化学知识与技能。请结合下列实验装置图回答问题。
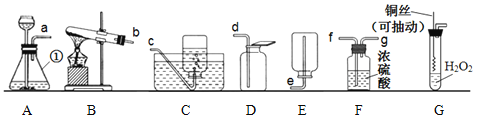
(1)写出图中①的仪器名称:_____________。
(2)实验室用过氧化氢制取氧气的化学方程式为______________________________,若要将产生的气体进行干燥,则应将a与F中的_________(选填小写字母)相连接。
(3)实验改进:查阅资料发现,氧化铜可以用作过氧化氢分解制氧气的催化剂。现有一根洁净的铜丝,实验前先将其烧成螺旋状,再经过加热处理。改进捕捉发生装置如图G所示。与装置A比较,改进后装置的优点是____________。
(4)甲烷是一种无色、无味、难溶于水、密度小于空气的气体,实验室若用加热无水醋酸钠和碱石灰的固体混合物的方法制取纯净的甲烷,选用的发生装置和收集装置为___________、_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:提示:(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解
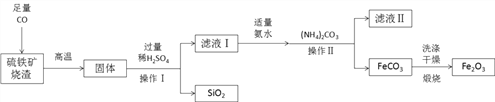
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、________等。
(2)滤液Ⅰ中主要的溶质是___________________。
(3)加适量氨水的目的是__________________________。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是__________________。
(5)滤液Ⅱ中可回收的产品是_____________(写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式_________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水和溶液在生产、生活中起着十分重要的作用。请回 答下列问题:
(1)对于静置沉淀、吸附沉淀、过滤、蒸馏等净化水的操作中,单一操作相对净化程度较高的是________。
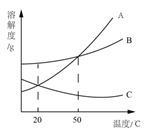
(2)根据右图 A、B、C 三种固体的溶解度曲线回答:
①50℃时,等质量的 A、C 的饱和溶液中溶剂的质量大小关系为: A_____C(填“>”、“=”或“<”)。
②将三种物质饱和溶液的温度分别从 50℃降到 20℃时,溶液中溶质的质量分数最大的 是_____________
(3)若要配制 98g 质量分数为 10%的稀硫酸,需要质量分数为 98%的浓硫酸(密度为1.84g/cm3)_____mL(计算结果保留一位小数)。在实验室用浓硫酸配制稀硫酸的主要步 骤有:计算、量取、_____、冷却至室温装瓶并贴上标签。
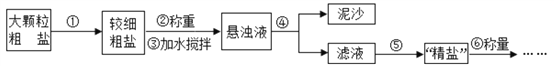
(4)粗盐提纯的步骤如下:
a.操作⑤中用到的仪器有铁架台、玻璃棒、酒精灯、坩埚钳、_________,其中玻璃棒的作用 是______________。
b. 实验结束后称量获得的精盐,并计算精盐的产率,发现产率偏低,其可能的原因是___________。
A、食盐没有全部溶解即过滤 B、蒸发时食盐飞溅剧烈
C、蒸发后,所得精盐很潮湿 D、器皿上沾有的精盐没全部转移到称量纸上
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】不含结晶水的甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
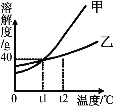
A. t1℃时,甲、乙饱和溶液中含溶质的质量相等
B. t1℃时,甲、乙两种物质各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g
C. t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D. t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是一切生物生存所必须的宝贵资源,我们应该了解有关水的一些知识。
(1)为了防止水的污染,下列做法有利于保护水资源的是_____(填序号):
①抑制水中所有动、植物的生长 ②不任意排放工业废水 ③大量使用化肥农药 ④生活污水经过净化处理后再排放
(2)有一种环保型消毒液发生器,其中发生的反应是氯化钠和水在通电条件下反应生成氢氧化钠、氢气和氯气(Cl2),该反应的化学方程式为_____;从能量变化角度看,该反应将电能转化为_____能。
(3)溶液在生产生活中有广泛的应用。某同学配置溶液时,在用量筒量取所需水的过程中,他俯视读数,这样配置得到的溶液溶质质量分数会_____(填“偏大”、“偏小”或“无影响”).10%的CaCl2溶液可用作路面保湿剂,欲配置100kg该路面保湿剂,需要水的质量_____kg。
(4)人们常饮用的一种矿泉水的标签如图所示,其中所含镁离子的离子符号为_____,该矿泉水是_____(填“中性”“酸性”或“碱性”),人体吸收该矿泉水中含有的某一元素可以防止佝偻病,这种元素是_____(填元素符号)。

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图所示的溶解度曲线(
A. B都为固态物质),判断下列说法中正确的是( )
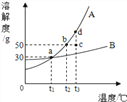
A.t1℃时,A和B饱和溶液的质量分数都为30%
B. t3℃时,A的溶解度比B大,故A溶液的质量分数也一定比B溶液大
C. B的浓溶液的质量分数一定比A的稀溶液大
D. 把c点对应A的溶液降温至t2℃可得A的饱和溶液,继续降温可析出A晶体
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】海洋中有丰富的资源,海水晒盐后,分离出食盐的海水称为苦卤水,其中含有丰富的MgCl2。工业上以苦卤水为原料制取金属镁(Mg)的流程如下:
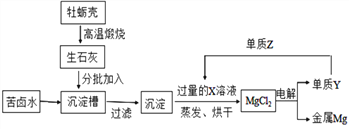
(1)从海水中析出食盐的结晶方法是______________
(2)Y与 Z 反应后的产物溶于水可得 X 溶液,从而实现了 Y 的循环利用,则 Z 的化学式为_____________
(3)烘干后得到的MgCl2中可能含有的杂质是_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com