
| 物质 | 氧气 | 甲烷 | 水 | 二氧化碳 | X |
| 反应前质量/g | 11.2 | 3.2 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 4.4 | 待测 |
| A. | 反应类型属于分解反应 | |
| B. | X中两种元素的质量比为1:1 | |
| C. | 反应后X的质量为3.6g | |
| D. | 反应方程式中氧气与水的化学计量数之比为7:8 |
分析 反应后甲烷质量减少3.2g,是反应物;
反应后氧气质量减少11.2g,是反应物;
反应后水的质量增加7.2g,是生成物;
反应后二氧化碳质量增加4.4g,是生成物;
根据质量守恒定律可知,X是生成物,生成的质量为:11.2g+3.2g-7.2g-4.4g=2.8g.
解答 解:A、反应物是两种,生成物是三种,不属于分解反应,该选项说法错误;
B、甲烷中氢元素质量是3.2g×$\frac{4}{16}$×100%=0.8g,碳元素的质量是3.2g-0.8g=2.4g,
7.2g水中氢元素的质量为:7.2g×$\frac{2}{18}$×100%=0.8g,氧元素质量为:7.2g-0.8g=6.4g,
4.4g二氧化碳中氧元素的质量为:4.4g×$\frac{32}{44}$×100%=3.2g,碳元素的质量是4.4g-3.2g=1.2g,
则X中氧元素的质量为:11.2g-3.2g-6.4g=1.6g,所以X中不含氢元素,X中含有碳元素的质量是2.4g-1.2g=1.2g,故X中两种元素的质量比为1.6:1.2≠1:1,该选项说法错误;
C、根据质量守恒定律可知,X是生成物,生成的质量为:11.2g+3.2g-7.2g-4.4g=2.8g,该选项说法错误;
D、由题意可知:反应中氧气和水的计量水之比:$\frac{11.2g}{32}:\frac{7.2g}{18}$=7:8,该选项说法正确.
故选:D
点评 本题考查学生利用表格中物质的质量及质量守恒来分析生成物,明确化学反应方程式中物质恰好完全反应的质量比及元素质量的计算是解答的关键.


科目:初中化学 来源: 题型:选择题
| A. | Na+、K+、OH-、SO42- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | Na+、Mg2+、SO42-、OH- | D. | Ca2+、SO42-、NO3-、CO32- |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 托盘天平是一种实验室常用的称量用具,请回答下列问题:
托盘天平是一种实验室常用的称量用具,请回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | K$\underset{Mn}{•}$O4 | B. | Na2$\underset{S}{•}$2O3 | C. | H2$\underset{C}{•}$2O4 | D. | Na2$\underset{Fe}{•}$O4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 1gH2和8gO2 | B. | 0.1mol HCl和2.24L氯化氢 | ||
| C. | 28gCO和22gCO2 | D. | 9gH2O和0.5molCO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
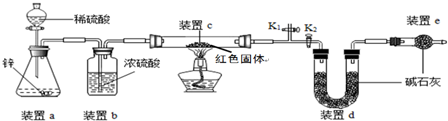
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com