
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
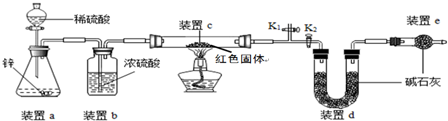
分析 探究一:【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3;
【设计实验】如果暗红色固体中含有Cu2O,加入稀硫酸时,Cu2O和稀硫酸反应生成硫酸铜,硫酸铜溶液是蓝色的;
探究二:
【方案一】(1)考虑操作A是过滤,掌握在实验室中完成过滤的玻璃仪器;
(2)考虑氢氧化钠与硫酸铜溶液反应生成蓝色沉淀;
(3)根据Cu2O+H2SO4=CuSO4+Cu+H2O,通过计算,如果假设3成立,可计算红色固体产物中Cu2O的含量;
【方案二】
(1)盐酸易挥发,容易挥发出氯化氢气体;
(2)考虑浓硫酸的吸水干燥作用;
(3)装置c中涉及的反应为:氢气与Cu2O生成铜与水;
(4)空气中含有水蒸气和二氧化碳,能够被碱石灰吸收;
(5)正确的顺序是:先连接仪器,检查装置的气密性,再关闭K2,打开K1,通氢气一段时间,把装置中的水蒸气和二氧化碳排出,再打开K2,关闭K1,点燃酒精灯;
(6)根据化学方程式化和质量守恒定律,计算产物中Cu2O的含量;
【交流与反思】
(1)根据在方案一的测定实验,考虑测定结果偏大的可能的原因;
(2)通过测定反应前后c装置的质量也可以达到实验目的.
解答 解:探究一:
【猜想与假设】因为Cu和Cu2O均为不溶于水的红色固体,则根据假设1、2,推测假设3为红色固体Cu、Cu2O的混合物;
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到固体部分溶解,溶液变成蓝色,即Cu2O+H2SO4=CuSO4+Cu+H2O,说明暗红色固体含有Cu2O.
探究二:
【方案一】称取5.00g红色固体加入到足量稀硫酸溶液中使其充分反应后,操作A、洗涤、干燥,称量得红色固体质量为4.10g.故:
(1)操作A的名称是 过滤,在实验室中完成操作A的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)检验反应后剩余红色固体是否洗涤干净的方法是:取少量最后一次洗涤液,加入氢氧化钠溶液,如果观察到现象:无蓝色沉淀生成,说明已洗涤干净.
(3)设红色固体产物中Cu2O的质量为x.
根据Cu2O+H2SO4=CuSO4+Cu+H2O 质量差
144 64 80
x 5.00g-4.20g=0.8g
则$\frac{144}{80}=\frac{x}{0.8g}$,解得x=1.44g
通过计算,假设3成立,红色固体产物中Cu2O的含量为1.44g
【方案二】
(1)装置a中用稀硫酸而不用稀盐酸,原因是盐酸易挥发,挥发出的氯化氢能被碱石灰吸收,影响测定结果.
(2)装置b的作用是 干燥氢气,若不加装置b,实验结果会偏大;
(3)装置c中涉及的反应化学方程式Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)若不加装置e,实验结果会偏高,原因是d中的碱石灰能够吸收空气中的水和二氧化碳,从而使测定的水的质量偏高,会导致计算的Cu2O的质量偏高,从而导致实验结果会偏大;
(5)点燃酒精灯前涉及的部分操作如下,①连接仪器;②检查装置的气密性;③关闭K2,打开K1,通氢气一段时间以赶尽装置内原有的空气,其目的是:a.防止空气中的H2O和CO2进入装置d干扰测定;b.防氢气不纯,发生爆炸,检验空气是否赶尽的方法是:在K1处用小试管收集气体,进行点燃实验;④打开K2,关闭K1;
(6)经测定反应前后装置d的质量分别为100.00g、100.18g,则根据质量守恒定律,生成水的质量为100.18g-100.00g=0.18g,则设产物中Cu2O的含量为x.
Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O
144 18
x 0.18g
则$\frac{144}{x}=\frac{18}{0.18g}$,解得x=1.44g
答:产物中Cu2O的含量为1.44g.
【交流与反思】
(1)在方案一实验测定中,若测定结果偏大,则下列可能的原因有:①反应后剩余红色固体未洗涤干净;②洗涤后未完全干燥;③干燥方法采用的是在空气中加热烘干,铜与氧气反应,使固体质量增加.而④称量剩余红色固体时,有部分固体洒落到实验台上,结果偏小,故选①②③.
(2)还可通过测定反应前后装置c的质量达到实验目的,反应前后装置c的质量差即为Cu2O中氧元素的质量,根据氧元素的质量可以计算Cu2O的质量,进一步可以计算产物中Cu2O的含量.故填:c.
故答案为:
【猜想与假设】红色固体Cu、Cu2O的混合物.
【实验探究】(填写表中空格):部分
探究二:【方案一】(1)过滤,漏斗;(2)氢氧化钠,无蓝色沉淀生成.(3)1.44g;
【方案二】(1)盐酸挥发出氯化氢气体,与d中的物质反应,影响测定结果;
(2)干燥氢气;偏大;(3)Cu2O+H2$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+H2O;
(4)防止空气中CO2及H2O对装置d的测量造成误差;偏大;
(5)②检查装置的气密性;③氢气不纯,发生爆炸;点燃;
(6)1.44g
【交流与反思】
(1)①②③;(2)c
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:选择题
| 物质 | 氧气 | 甲烷 | 水 | 二氧化碳 | X |
| 反应前质量/g | 11.2 | 3.2 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 4.4 | 待测 |
| A. | 反应类型属于分解反应 | |
| B. | X中两种元素的质量比为1:1 | |
| C. | 反应后X的质量为3.6g | |
| D. | 反应方程式中氧气与水的化学计量数之比为7:8 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Cu粉 Fe粉 Fe2O3粉 | |
| B. | Na2CO3 BaCl2 KNO3 | |
| C. | NaCl固体 CuSO4固体 CaCO3固体 | |
| D. | (NH4)2SO4 KNO3 NaNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 点燃某可燃物,在火焰上罩一个冷而干燥的烧杯,烧杯的内壁有水雾出现,证明可燃物一定是含有H | |
| B. | 实验室用大理石与盐酸反应制取的CO2通入澄清石灰水无沉淀生成,可能是因为盐酸太浓 | |
| C. | 某混合气体能使灼热的氧化铜变成红色固体,且导出后气体能使澄清石灰水变浑浊,证明原气体中一定含有一氧化碳 | |
| D. | 含二氧化碳、一氧化碳、氢气、水蒸气、氮气的混合气体,依次通过石灰水、灼热的氧化铜、干燥剂碱石灰(假定每步都充分吸收),最后一定只剩下氮气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | NO | B. | NO2 | C. | N2 | D. | H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com