
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.3%NaCl溶液(ml) | 1%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝色 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝色 |

分析 (1)酶具有1、高效性 2、专一性 3、多样性 4、温和性 5、活性可调节性 6.有些酶的催化性与辅因子有关 7.易变性 大多数酶是蛋白质,因而会被高温、酸、强碱等破坏;
(2)通过观察图可知,不同的是1号试管加入的是水,2号试管加入的是唾液,该实验设置了对照实验,变量是唾液,目的是探究唾液对淀粉的消化作用;
(3)根据控制变量分析;
(4)氯化钠可以将银离子转化为沉淀,
(5)根据重金属盐中毒的原理判断,即破坏人体的蛋白质结构,使之失去生理功能;重金属可使蛋白质变性而中毒,误食重金属盐,可马上服用大量的豆浆或牛奶,可起到缓冲的作用.
解答 解:(1)小刚同学提出猜想的依据是:酶是一种 蛋白质,遇到重金属离子会变性,从而丧失活性.
(2)1号试管加入的是水,滴加碘液变蓝,2号试管加入的是唾液,滴加碘液不变蓝,比较上述实验中的1号和2号试管及观察到的现象,你可得出的结论是:唾液淀粉酶能分解淀粉.
(3)实验中盐用的是NaCl溶液和CuSO4溶液,除了金属离子不同,酸根离子也不同,可以将将实验中的CuSO4溶液更换成CuCl2溶液或将NaCl溶液换成Na2SO4溶液;
(4)氯化钠可以硝酸银反应,将银离子转化为沉淀,方程式为:NaCl+AgNO3=NaNO3+AgCl↓
(5)重金属盐中毒的原理即破坏人体的蛋白质结构,蛋清的主要成分是蛋白质.鸡蛋清、豆浆、牛奶中含有蛋白质,服用鸡蛋清、豆浆、牛奶,可防止人体本身的蛋白质被破坏,能用于解毒,而糖水不能用于解毒.
故答案为:(1)蛋白质;
(2)唾液淀粉酶能催化淀粉的分解;
(3)将NaCl溶液换成Na2SO4溶液;
(4)NaCl+AgNO3=Na NO3+AgCl↓;
(5)④.
点评 本题考查蛋白质的性质,题目难度不大,了解中毒原理、或事故发生原因,才会正确对事故进行处理,保障人的生命安全.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
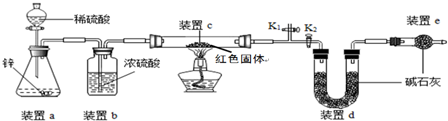
| 实验操作 | 实验现象 | 实验结论 |
| 取少量红色固体加入到足量稀硫酸溶液中 | 若无明显现象 | 假设1成立 |
| 若固体部分(选填“全部”或“部分”)溶解,溶液由无色变蓝色 | 假设2和假设3均成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:
研究金属与水的反应是研究金属化学性质的重要手段.较高温度下铁粉能与水蒸气反应是铁作为一种较活泼金属的有力证据.某校科学兴趣小组同学利用如图所示装置成功地完成了该实验.在高温下普通铁粉与水蒸气反应,生成铁的氧化物(与铁在氧气中的燃烧产物相同)和氢气,氢气可以在装置右端的支管处被点燃.根据以上信息回答:| 铁粉质量/g | 0.2 | 0.4 | 0.6 | 0.8 |
| 第一次反应时间/S | 91 | 40 | 45 | 99 |
| 第二次反应时间/S | 84 | 44 | 50 | 82 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 混合后溶液的质量分数c%=$\frac{a%+b%}{2}$ | |
| B. | 混合后所得溶液中溶质的溶解度将改变 | |
| C. | 混合后的溶液可能是硝酸钾的饱和溶液 | |
| D. | 混合后所得溶液的质量分数肯定介于a%与b%之间 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 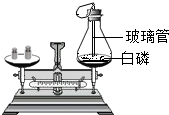 测量白磷燃烧前后质量变化值 | B. |  检查装置气密性 | ||
| C. | 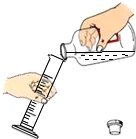 量取液体 | D. |  收集CO2气体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
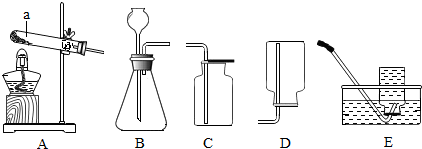
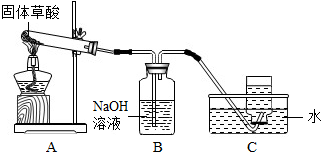 某化学课题小组通过查阅资料得知:固体草酸(H2C2O2•2H2O)受热可分解,其化学方程式(H2C2O2•2H2O═CO↑+CO2↑+3H2O)该课题小组的同学在实验室分别进行了如下实验,请回答下列问题:
某化学课题小组通过查阅资料得知:固体草酸(H2C2O2•2H2O)受热可分解,其化学方程式(H2C2O2•2H2O═CO↑+CO2↑+3H2O)该课题小组的同学在实验室分别进行了如下实验,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com