
【题目】一定条件下,在一个密闭容器内发生某反应,测得反应前后各物质的质量如图所示,下列说法正确的是( ) 
A.X的值为22
B.该反应属于置换反应
C.W由碳、氢两种元素组成
D.W中碳、氢元素原子个数比为1:4
【答案】D
【解析】解:由于四种物质中W和氧气质量减小,所以是反应物,且反应物的总质量是8g+(20g﹣8g)=20g,而水的质量增加,且增加值是10g﹣1g=9g,依据质量守恒定律参加化学反应的各物质质量总和等于反应后生成的各物质质量总和,所以二氧化碳必是生成物且生成的质量是20g﹣9g=11g;此反应的表达式可表示为W+O2→CO2+H2O. A、X的值为11,错误;
B、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种化合物,不属于置换反应,错误;
C、根据质量守恒定律,由反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素的质量为:9g× ![]() =8g,二氧化碳中氧元素的质量:11g×
=8g,二氧化碳中氧元素的质量:11g× ![]() =8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
=8g,两者的质量和为16g,而参加反应的氧气的质量20g﹣8g=12g,所以可判断W中含有氧元素,错误;
D、W中碳、氢元素原子个数比为: ![]() :
: ![]() =1:4,正确.
=1:4,正确.
故选D.
【考点精析】通过灵活运用质量守恒定律及其应用,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏即可以解答此题.


 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:初中化学 来源: 题型:
【题目】X可以发生如下反应:(1)X+酸===盐+水;(2)X+非金属氧化物===盐+水。X可能是( )
A. 氧化铜 B. 盐酸
C. 氢氧化钠 D. 碳酸钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在世界范围内,据统计化肥对粮食增产的贡献率已超过40%.下图是两种氮肥标签的一部分.请根据图示中的信息回答下列问题: 
(1)从标签上看,碳酸氢铵不同于尿素的化学性质的是: (填字母序号);
A.易溶于水
B.受热易分解
C.有挥发性
(2)碳酸氢铵中氮、氢、碳、氧四种元素的质量比为;
(3)尿素的相对分子质量为;
(4)计算:①纯尿素中氮元素的质量分数;
②这种尿素肥料中尿素的质量分数至少为多少?(本小题共4分,要求写出计算过程,计算结果精确至0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法,正确的是 ( )
A. 向蛋白质溶液中加入硫酸钠溶液会变黄
B. 蛋白质加热后会变成黄色固体
C. 食物要在甲醛溶液中长时间浸泡后才能食用
D. 青少年在成长过程中要补充较多量的蛋白质和油脂
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】汽车制造是盐城市的支柱经济产业之一,汽车制造过程中要用到大量的铁、铜、铝等金属材料,请按要求填空.
(1)汽车制造中用得最多的金属材料是钢.钢(填“是”或“不是”)纯金属.车体表面喷漆不仅美观,而且可有效防止钢铁与接触而生锈.炼铁的原理是利用一氧化碳与氧化铁反应还原出铁,反应的化学方程式为 .
(2)汽车电路中的导线大都是铜芯的,这主要是利用了铜的性.将赤铜矿(主要成分Cu2O)和辉铜矿(主要成分Cu2S)混合焙烧可得到铜,请将反应的方程式补充完整:2Cu2O+Cu2S ![]() 6Cu+ .
6Cu+ .
(3)铁、铜、铝三种因素在地壳中的含量多少顺序为Al>Fe>Cu,但三种金属被人类发现和利用的时间是铜最早,而铝最晚,这跟它们的有关.铝具有很好的抗腐蚀性能,原因是 .
(4)镁铝合金是汽车制造中的重要材料之一.为测定某镁铝合金(只含镁、铝两种元素)的组成成分,某学习小组取3.9g合金粉末加入100.0g过量的盐酸中,向充分反应后的溶液中加入过量20.0%的氢氧化钠溶液,最终得到沉淀2.9g.
【质疑】通过讨论,大家认为得到的沉淀质量数据可能有问题.按初中化学现有知识计算,沉淀的质量至少为 g.
(5)【探讨】经向老师请教,同学们了解到氢氧化铝沉淀可与氢氧化钠溶液反应,产生可溶性的偏铝酸钠,反应如下:NaOH+Al(OH)3═NaAlO2+2H2O
【计算】若已知产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示,请计算:
①该合金中镁的质量为 g;铝的质量为 g.
②加入的盐酸溶质质量分数为多少?(请写出计算过程)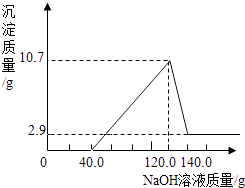
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列实验装置回答问题. 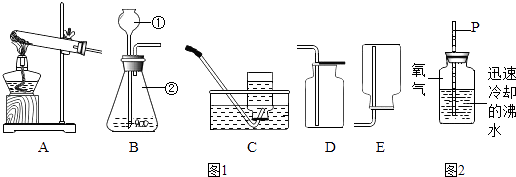
(1)写出仪器①和②的名称:①是 , ②是 .
(2)实验室常用B装置制取二氧化碳,发生反应的化学方程式为 , 用该发生装置可以制取氧气,反应的化学方程式为 , 收集氧气的装置为(填字母序号)
(3)加热二氧化锰和氯酸钾的固体混合物生成氯化钾和氧气,应选用的发生装置为(填字母序号),二氧化锰是该反应的催化剂,则二氧化锰的和化学性质在反应前后没有发生变化,实验结束后,欲从氯化钾和二氧化锰的混合物中回收二氧化锰,需要进行溶解、洗涤、干燥等操作.
(4)向盛有氧气的集气瓶中倒入迅速冷却的沸水,立即塞紧穿有两端开口细玻璃管的橡皮塞,用注射器向玻璃管中注水至P处,装置如图2所示. ①手拿集气瓶在水平面上摇晃数十次后,看到玻璃管中的液面将(选填“上升”、“下降”或“不变”).
②下列有关该实验的说法正确的是 .
a.可说明有少量氧气溶于水中
b.应保证装置有良好的气密性
c.用迅速冷却的沸水是因为其中几乎不含氧气.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用如图1装置,小卫设计并实施了下列实验,(压强传感器用于测量抽滤瓶内压强变化:各数据均于同温下测定获得) 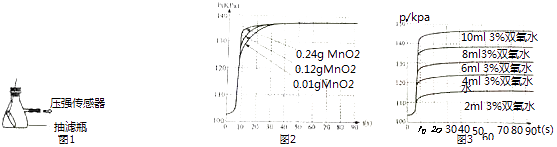
实验Ⅰ:再小试管中加入8mL溶质质量分数为3%的双氧水(ρ=1g/mL),在抽滤瓶中分别加入不同质量的MnO2 , 使其反应并启动传感器,记录容器内压强变化于图2中.
实验Ⅱ:在抽滤瓶中加入0.1g MnO2 , 在小试管中分别加入不同体积溶质质量分数为3%的双氧水,使其反应并启动传感器,记录容器内压强变化于图3中.
请根据以上实验回答下列问题:
(1)使容器内压强增大的反应的化学方程式: .
(2)根据图2可发现,该实验条件下,30s内催化分解8mL溶质质量分数为3%的双氧水,MnO2的最小用量为g;
(3)根据图3可发现,0.1g MnO2至少能快速催化分解g过氧化氢;
(4)根据图2与图3可发现,MnO2的用量总体上与O2产量(填“正相关”、“不相关”或“负相关”),根据图3还可发现,该试验中,O2产量总体上与双氧水用量是(填“正比”或“反比”);
(5)下列因素中,与本实验所测数据的精确度有关的是
A.反应容器的气密性
B.称量MnO2质量的精准度
C.量取双氧水体积的精准度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com