
【题目】(1)用化学用语填空:保持氮气化学性质的最小粒子____________;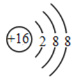 ____________。
____________。
(2)随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如下(图中的微粒恰好完全反应)所示。请根据微观示意图回答以下问题。
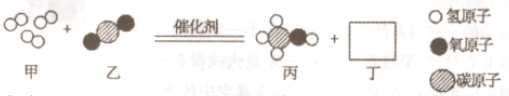
丁的化学式为____________,将二氧化碳转化成液体燃料甲醇可以减缓____________。
(3)我国化工专家侯德榜发明的“联合制碱法”为世界制碱工业做出了突出贡献。他以食盐、水、氨气、二氧化碳为原料,先制得碳酸氢钠和氯化铵,进而生产出纯碱。下表是几种物质在不同温度时的溶解度:
温度(℃) | 20 | 40 | 50 | 60 | |
溶解度/g | NaCl | 36.0 | 36.6 | 37.0 | 37.3 |
NH4Cl | 37.2 | 45.8 | 50.4 | 55.2 | |
Na2CO3 | 21.8 | 48.9 | 47.5 | 46.5 | |
①20℃时,100克水中最多溶解Na2CO3____________克。
②60℃,分别取 Xg NaCl和XgNH4Cl固体加入两只烧杯中,进行如下实验。

加入甲烧杯中的固体是__________,甲烧杯中未溶解的固体最多有_____________g。
③下列说法正确的是________(填字母编号)。
A 该生产原料之一是饱和食盐水,室温下配制饱和食盐水的质量分数约为26.5%
B 生产中需通入氨气及二氧化碳,若要提高这些气体的溶解度,可通过增加水量来提高
C NH4C1和NaC1混合溶液中可以通过蒸发结晶的方法获得较多的NH4C1晶体
D “联合制碱法”得到的产品之一NH4Cl可作为氮肥使用
【答案】N2 S2- H2O 温室效应 21.8 氯化钠 17.9 AD
【解析】
(1)氮气是由氮分子构成的,构成物质的分子是保持该物质化学性质的最小粒子,故保持氮气化学性质的最小粒子是氮分子,分子用化学式表示,表示为:N2;
质子数大于核外电子数,表示阴离子,质子数=原子序数=16,16号元素为硫元素,故该粒子为硫原子得到2个电子后形成的硫离子,离子的表示方法:在该离子元素符号的右上角标上该离子所带的正负电荷数,数字在前,正负号在后,带一个电荷时,1通常省略,故硫离子表示为:S2-;
(2)根据质量守恒定律,化学反应前后,原子的种类和数目不变,由图可知,反应物中含1个碳原子、2个氧原子、6个氢原子,生成物中含1个碳原子、1个氧原子、4个氢原子,故生成物中还应含1个氧原子,2个氢原子,故丁的化学式为:H2O;
将二氧化碳转化为甲醇,可以减少空气中二氧化碳的含量,减缓温室效应;
(3)①由表中数据可知,20℃时,碳酸钠的溶解度为21.8g,即该温度下,100g水中最多能溶解21.8g碳酸钠,故填:21.8;
②由图可知,60℃时,氯化钠的溶解度是37.3g,氯化铵的溶解度是55.2g,该温度下,分别取 Xg NaCl和XgNH4Cl固体加入两只烧杯中,各加100g水,甲有固体未溶解,乙固体全部溶解,已知该温度下,氯化铵的溶解度大于氯化钠,故加入甲烧杯中的固体是氯化钠;
乙全部溶解,乙可能恰好达到饱和,也可能是不饱和溶液,当乙恰好饱和时,溶解的质量最大,这时甲未溶解的固体最多,如果乙恰好达到饱和,则加入甲、乙的质量为55.2g,甲未溶解的固体质量为:55.2g-37.3g=17.9;
③A、由表中数据可知,20℃时,氯化钠的溶解度是36g,该温度下,饱和食盐水的溶质质量分数为:![]() ,符合题意;
,符合题意;
B、在压强、温度一定的条件下,溶解度是一个定值,不随水的质量增加而增加,不符合题意;
C、由表中数据可知,氯化钠、氯化铵的溶解度都随温度的升高而增加,氯化铵的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小,故NH4Cl和NaCl混合溶液中可以通过降温结晶的方法获得较多的NH4Cl晶体,不符合题意;
D、氯化铵含营养元素氮元素,属于氮肥,符合题意。
故选AD。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:初中化学 来源: 题型:
【题目】黄钠铁矾[NaFex(SO4)y(OH)z]是一种高效净水剂。
Ⅰ、黄钠铁矾的制备:
用废铁屑(主要成分为Fe,含少量Fe2O3和FeCO3)制备黄钠铁矾的主要流程如下图所示

(1)酸溶前将废铁屑研磨成粉末的目的是_____。
(2)酸溶时,H2SO4除了与Fe、FeCO3反应外,还发生反应的化学方程式_____和Fe+Fe2(SO)4=3FeSO4.酸溶后所得的混合溶液中一定含有的溶质有_____(填化学式)。
Ⅱ、黄钠铁矾组成的探究:用下图所示的装置对黄钠铁矾进行热分解实验

(查阅资料)
(1)NaFex(SO4)y(OH)z在T℃时分解生成H2O(气态)、SO3(气态),并得到Fe2O3和Na2SO4;
(2)无水氯化钙不能吸收SO3,浓硫酸可用于吸收SO3;
(3)碱石灰是氢氧化钠和生石灰的混合物。
(实验步骤)
(1)装配好实验装置,_____。
(2)向A装置中加入4.85g黄钠铁矾,装配好实验装置,通入一段时间N2。
(3)停止通入N2,对A中固体加热,控制温度在T℃。
(4)待反应完全后,继续通入一段时间N2。
(5)将A装置中的残留固体溶于足量水,过滤、洗涤、烘干得2.40g固体,将滤液蒸干得0.71g固体(不含结晶水)。
(实验结论)
(1)假设实验条件下反应生成的气态物质能全部被相应装置吸收,若实验后测得B装置质量增加0.54g,则C装置质量增加_____g。
(2)若NaFex(SO4)y(OH)z,中y=2,则黄钠铁矾的化学式为_____。
(实验反思)
(1)加热后需通入一段时间N2,其目的是_____。
(2)该实验中D装置的作用为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学概念在逻辑上存在如图所示关系,对下列概念说法正确的是( )

A.氧化物与化合物属于包含关系
B.单质与化合物属于交叉关系
C.混合物与纯净物属于交叉关系
D.化合与分解反应属于并列关系
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了SO2,同时还得到了某种化工产品,工艺流程如图所示。下列叙述正确的是
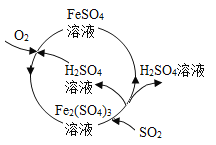
A.图中FeSO4→Fe2(SO4)3的反应类型属于复分解反应
B.该流程中化合价发生改变的元素只有Fe和O
C.该流程中硫酸不可以循环利用
D.图中吸收SO2的化学方程式:![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是某汽车尾气净化装置中发生反应的微观示意图。下列说法正确的是
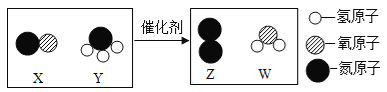
A.Y、W属于氧化物
B.该反应的化学方程式为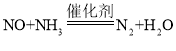
C.该反应中X、Y两物质的质量比为28:17
D.反应前后,原子种类、原子数目不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】高纯氧化铁可作为现代电子工业的材料,以下是硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40℃以上时(NH4)2CO3分解]。
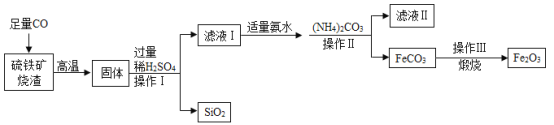

(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器玻璃棒、_______、烧杯等。
(2)写出通入CO后所发生反应的化学方程式_______(任意写一个)。
(3)在该生产流程中当加入(NH4)2CO3后,应该控制的条件是 ______ 。
(4)滤液Ⅱ中可回收的物质在农业上可做 _____
(5)写出在空气中煅烧FeCO3的化学方程式_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请根据下列A﹣G实验装置回答有关问题:
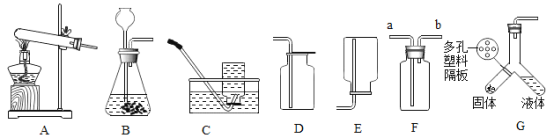
(1)实验室中制取一瓶干燥的氧气应选择的装置是____,发生反应的化学方程式是____
(2)用装置F收集氧气验满的方法是____________
(3)将装置G倾斜使两种药品混合可用于制取CO2,与B装置相比较该装置的优点是____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸乙烯酯(C3H4O3)可用作锂电池电解液,下列有关碳酸乙烯酯的说法正确的是
A.碳酸乙烯酯的相对分子质量为(12×3+1×4+16×3) g
B.碳酸乙烯酯中C、H、O三种元素的质量比为12:1 : 16
C.碳酸乙烯酯中C元素的质量分数=12÷(12+1+16)×100%
D.碳酸乙烯酯中C、H、O三种原子的个数比为3:4:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】钛和钛合金被认为是21世纪重要的金属材料。钛合金与人体具有很好的“相容性”,可用于制造人造骨骼。工业上以钛铁矿(主要成分为钛酸亚铁,FeTiO3)为原料生产钛,其工业流程示意图如下:
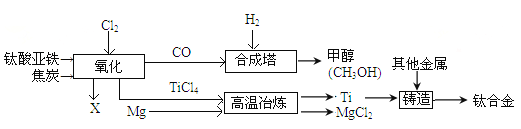
请回答:(1)钛合金属于_______(选填“混合物”、“纯净物”)。
(2)钛酸亚铁FeTiO4中钛的化合价为______价。
(3)以CO和H2在合成塔中生产甲醇(CH3OH)属于化合反应,其化学方程式为________________。
(4)经高温冶炼得到金属钛,则参加反应的镁与生成钛的质量比为_________。
(5)氯化过程中主要发生的反应为2FeTiO3+6C+7Cl2![]() 2TiCl4+2X+6CO,则X的化学式为______。
2TiCl4+2X+6CO,则X的化学式为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com