
【题目】为探究铁、锌、铜、铝、银五种金属的活动性顺序,进行如图所示的实验。(实验前金属片表面均打磨过)
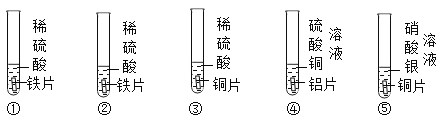
(1)实验④中反应的化学方程式为____________。
(2)通过以上实验可以得出什么结论___________?
(3)为证明五种金属的活动性顺序,在以上实验的基础上需要补做实验,要求除金属单质外,只能再选一种试剂,写出实验操作、现象和结论。___________
【答案】2Al+3CuSO4=Al2(SO4)3+3Cu 铝、锌、铁比铜活泼,铜比银活泼 取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼
【解析】
(1)实验④中铝和硫酸铜反应生成硫酸铝和铜,反应的化学方程式为:2Al+3CuSO4=Al2(SO4)3+3Cu.
故填:2Al+3CuSO4=Al2(SO4)3+3Cu.
(2)①中产生气泡,说明铁在金属活动性顺序中排在氢前面,②中产生气泡,说明锌在金属活动性顺序中排在氢前面,③中无明显现象,说明铜在金属活动性顺序中排在氢后面,④中铝片表面附着红色固体,说明铝比铜活泼,⑤中铜片表面附着银白色固体,说明铜比银活泼,因此可以得出什么结论是:铝、锌、铁比铜活泼,铜比银活泼.
故答案为:铝、锌、铁比铜活泼,铜比银活泼.
(3)实验方案是:取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼.
故答案为:取两支试管,分别加入适量硫酸锌溶液,其中1支试管中放入铁片,1支试管放入铝片,铁片表面无明显现象,说明锌比铁活泼,铝片表面附着银白色固体,说明铝比锌活泼.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:初中化学 来源: 题型:
【题目】为验证Fe、Cu、Ag 3种金属的活动性顺序,某小组同学设计了如图所示的4种实验方案(不做其他实验).其中不能达到目的是( )
A. 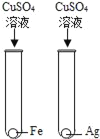 B.
B. 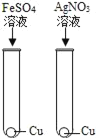
C. 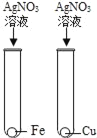 D.
D. 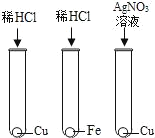
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下列实验装置图回答问题。
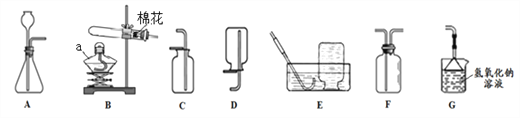
(1)仪器a的名称是______________。
(2)写出实验室用B装置制取氧气的化学方程式__________________;用E装置收集氧气的适宜时刻是____________________________。
(3)硫化氢(H2S)气体是一种有臭鸡蛋气味的有毒气体,易溶于水且水溶液呈酸性。其实验室制取原理是FeS(固)+H2SO4(稀)=FeSO4+H2S↑。要制取该气体,应选择发生和收集装置________(填标号),并用装置__________处理尾气防止污染空气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据报道,我国将印制塑料钞票,这种钞票是由特殊的聚酯材料印制而成,具有高防伪、硬度接近于钞票纸、不易产生褶皱、抗腐蚀性强、能燃烧、回收方便等特点.某种聚酯塑料,其化学式为(C9H8O3)n,可能成为其印制材料.回答下列问题:

(1)聚酯塑料属于 (填“无机物”或“有机物”);
(2)写出聚酯塑料的化学性质 (写出一条即可);
(3)上述聚酯塑料中C、H、O三种元素的质量之比为 ,其中C元素的质量分数是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】超细碳酸钙可用于生成钙片、牙膏等产品。利用碳化法生成超细碳酸钙的主要流程示意如下:
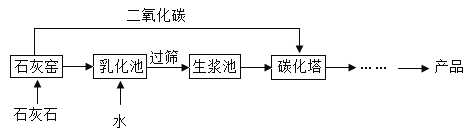
(1)写出该流程中一种氧化物的化学式_____。
(2)过筛操作原理类似于净水操作中的_____,经过处理后滤液仍然浑浊,写出一种可能的原因_____。
(3)写出“碳化塔”中发生反应的化学方程式__________。
(4)碳酸钙的用途很多,除了用于补钙,做摩擦剂外,还可以用作_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】利用数字化实验可以更准确地比较不同状态的碳酸钙与稀盐酸反应的速率。如图所示,倾斜锥形瓶使试管内稀盐酸流入瓶中与固体发生反应,瓶内气压的变化如曲线所示。下列有关说法正确的是:
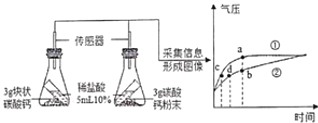
A. 曲线①表示的是块状碳酸钠与稀盐酸的反应
B. b点表示碳酸钙与盐酸反应已停止
C. 等质量不同状态的碳酸钙参加反应,粉末状碳酸钙产生CO2质量更多
D. 对比曲线①②中c、d两点可知,产生相同质量的二氧化碳,粉末状碳酸钙用时更少
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用图实验装置做了以下两个实验。
实验装置 | (实验一)研究燃烧条件 | (实验二)研究CO2与固体NaOH的反应 |
| 关闭K1和K2,在C中加入少量白磷,并加入热水浸没白磷。塞好胶塞,使导管口浸入热水中,发现白磷不燃烧;打开K2,将A中过氧化氢溶液滴入盛有MnO2的锥形瓶B中,马上关闭K2;打开K1,C中有气泡胃出,白磷立即燃烧 | 关闭K1和K2,A中盛有稀盐酸、B中盛放Na2CO3固体、C中是NaOH固体;打开K2,将A中液体滴人B中;一段时间后,用燃着的木条放在K2导管口,发现木条立即熄灭;再关闭K2,打开K1,待气球变鼓后,关闭K1,打开K2。 |
(1)实验一,锥形瓶B中发生的化学反应方程式为___。通过实验一可知,燃烧需要满足的一个条件是_______
(2)实验二,装药品前要检验B装置的气密性,需要进行的操作是_______
(3)两个实验中,气球分别所起的作用是_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组通过探究活动学习和理解化学知识.请你一起研究学习,并回答有关问题.
研究主题:水溶液中复分解反应的实质
相关信息:一定体积的溶液中,离子的数目越多,其离子的浓度越大.电导率传感器用于测量溶液的导电性强弱,能反映离子浓度大小.相同温度下同种溶液电导率越大,离子浓度越大.
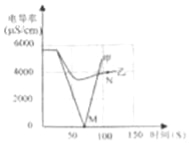
(1)实验一:恒温条件下,向一定体积一定浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀硫酸,测得溶液的电导率变化如图中甲曲线所示.
①写出Ba(OH)2与H2SO4反应的化学方程式 .
②甲曲线M点时混合液体呈 色;
③通过对甲曲线的分析,下列说法错误的是 (填序号).
A.M点前曲线下滑的过程中,H+和OH﹣结合成H2O,Ba2+和SO42﹣结合成BaSO4
B.M点时离子浓度几乎为零 C.M点后溶液电导率逐渐增大,仅由于溶液中H+在逐渐增大
(2)实验二:恒温条件下,向等量同浓度的稀Ba(OH)2溶液中滴加2﹣3滴无色酚酞试液,插入电导率传感器,然后滴加稀Na2SO4溶液,测得溶液的电导率变化如上图乙曲线所示.
①通过对乙曲线的分析,下列说法错误的是 (填序号).
A.开始至完全反应过程中,电导率减小,溶液由红色逐渐变为无色
B.电导率下降到最低点时仍然较大,表明溶液中还存在较多离子
C.整个实验过程中,溶液中Na+数目一直增大
②N点时,溶液中含有的离子是 (填离子符号).
③通过比较分析,结合已学知识可知,溶液中复分解反应的实质是参与反应的离子,结合生成了沉淀、气体或水,导致其浓度 (填“增大”或“减小”).
(3)拓展:①请根据示例仿写离子方程式.
示例AgNO3+NaCl=AgCl↓+NaNO3离子方程式:Ag++Cl﹣=AgCl↓
仿写:BaCl2+Na2SO4=BaSO4↓+2NaCl离子方程式: .
②向一定量饱和澄清石灰水中持续通入过量的CO2气体,溶液先变浑浊后浑浊逐渐消失.请推测此过程的溶液中Ca2+的浓度变化情况 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有193.8g硫酸铜溶液的烧杯中,逐滴加入质量分数为8%的氧氧化钠溶液,反应过程中生成沉淀的质量与所用氧氧化钠溶液的质量关系如图所示。
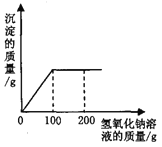
(化学方程式为 CuSO4+ 2NaOH = Cu(OH)2↓+ Na2SO4)
请计算:
(1)恰好完全反应时生成沉淀的质量。
(2)恰好完全反应时溶液中溶质的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com