
【题目】下表是元素周期表中1—18号元素的排列情况。根据此表我对它进行探究:
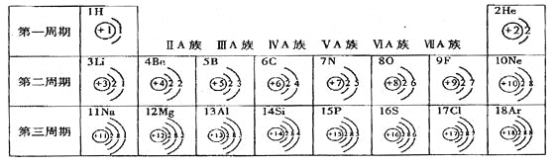
(1)第16号元素的名称是 (10) 。通过对元素周期表的分析,我能得出的一条信息是(11) 。
(2)第16号元素属于 (12) 元素(填“金属”或“非金属”),它的原子在化学反应中容易 (13)
电子(填“得”或“失”),它的离子符号为 (14) 。
(3)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强。由此推断:第二周期中得电子能力最强的的是 (15) 原子;失电子能力最强的是 (16)
原子,具有稳定结构的是 (17) 原子。
(4)某元素的原子结构示意图为 ,则它位于元素周期表中的第 (18) 周期,该元素的化学性质与上表中第 (19) 族元素的化学性质相似。
,则它位于元素周期表中的第 (18) 周期,该元素的化学性质与上表中第 (19) 族元素的化学性质相似。
【答案】 (10)硫(11)略(12)非金属 (13)得(14) S2- (15)F
(16)Li (17)Ne(18)五 (19) ⅦA
【解析】
(1)第16号元素的名称是硫,由表中可以发现相同周期元素电子层数相同,同时同族元素最外层电子数相同(氦除外,其最外层电子最多排两个电子);
(2)第16号元素为硫元素,属于非金属元素,因其原子结构中最外层电子数为6,所以在反应中容易得到2个电子,从而达到稳定结构,硫原子变为硫离子,带2个单位的负电荷,其符号为S2﹣;
(3)在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强.由此推断:第二周期中得电子能力最强的是F原子,失电子能力最强的是Li原子,具有稳定结构的是Ne原子,其原子最外层电子已经排满为8个电子,不容易失去也不容易得到电子;
(4)根据原子序数等于核电荷数,由图可知该原子核电荷数为53,即原子序数为53,根据该元素的原子最外层电子数为五层,可推出该元素位于元素周期表中的第五周期;元素的化学性质与最外层电子数有关,因其最外层电子数为7 ,故其化学性质与上表中第ⅦA族元素的化学性质相似。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】实验室常利用以下装置完成气体制备及性质实验.请回答:
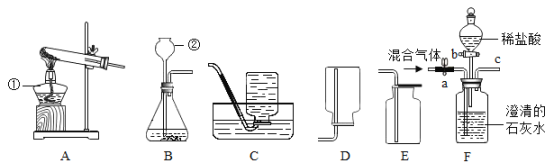
(1)指出编号仪器的名称:①________,②________.
(2)以上________(从A﹣E中选择)装置有一处明显的错误,请加以改正________.利用改正后的装置继续完成后面的实验.
(3)欲使用高锰酸钾制取氧气,应选择的发生装置是________(填字母),反应原理用化学方程式表示为________;使用该实验装置制取氧气存在不足之处,应采取的改进措施是________;若使用C装置收集氧气,实验结束时,应先从水槽中移出导气管,再熄灭酒精灯,原因是________.请简述如何组装一套给试管里的固体加热的装置________.
(4)将CO2和CO的混合气体通过F装置(液体药品均足量),实验开始时关闭活塞b,打开活塞a,广口瓶中观察到的现象是________,此时从导管c逸出的气体主要是________.一段时间后,再关闭活塞a,打开活塞b,将分液漏斗中的稀盐酸滴入广口瓶中,此时逸出的气体主要是________,反应原理用化学方程式表示为________,欲收集该气体,应选择的装置是________(填字母),验满的方法是________.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组在学习了催化剂的知识后,想探究氧化铜能否在过氧化氢溶液分解反应中起到催化作用。请你一起参与他们的探究过程,并填写下列空白。
(问题)CuO能不能作过氧化氢溶液分解反应的催化剂呢?
(猜想)____________。
(实验验证)
实验 | 实验步骤 | 实验现象 | 实验结论 |
实验一 | 在试管中加入少量的H2O2溶液,然后将带火星的木条伸入试管中 | ________ | 常温下H2O2溶液分解速率非常缓慢,放出很少量氧气 |
实验二 | 在装有H2O2溶液的试管中加入少量的CuO,然后将带火星的木条伸入试管中 | 有较多气泡产生,木条复燃 | ____________ |
(讨论与反思)经过讨论,有的同学认为只有上述两个实验,不能证明CuO能作过氧化氢溶液分解反应的催化剂,还要补充一个探究实验。
实验三:
(实验目的)探究_____________。
(实验步骤)①准确称量CuO(少量)的质量;
②重复实验二的步骤;待反应结束,将试管里的物质过滤,洗涤,干燥,称量;
③对比反应前后CuO的质量。
(讨论)如果_______________,则说明CuO能作过氧化氢溶液分解反应的催化剂。
但小华认为,要证明猜想,上述三个实验还不足以说明,还需要再增加一个实验。
(实验目的)________________。
(实验结论)CuO能作过氧化氢溶液分解反应的催化剂,请写出CuO催化过氧化氢分解的文字表达式:
_______________。
(拓展探究)同种催化剂,还有哪些因素会影响过氧化氢分解反应的催化效果?
假设:________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】MgSO4·7H2O是一种重要的化工原料,某工厂以一种镁矿石(主要成分为SiO2和MgCO3,还含有少量FeCO3)为原料制备MgSO4·7H2O的主要流程如下:
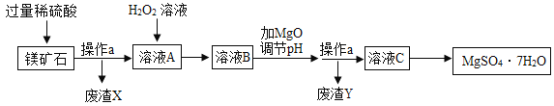
已知:SiO2既不溶于水也不溶于稀硫酸。请回答下列问题:
(1)“操作a”的名称是______。
(2)“废渣Y”中含有少量的FeOOH,其中铁元素的化合价是______。
(3)MgCO3溶于稀硫酸的化学方程式为______。
(4)“溶液A”中加入H2O2溶液会生成Fe2(SO4)3,该反应的化学方程式为______。
(5)选用MgO调节pH使Fe3+转化为沉淀,而不选用NaOH的原因是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】花青素(化学式为C15H11O6)具有缓解疲劳、保护视力的作用,该物质主要来源于各种蔬菜和水果,请回答下列问题:
(1)一个花青素分子中共有____________个原子;
(2)花青素分子中碳、氧元素的质量比为________________;
(3)花青素的相对分子质量为__________________;
(4)花青素中氧元素的质量分数为_________________。(计算结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某研究小组为探究“影响铁制品锈蚀快慢的因素”,取同浓度的稀氨水和稀醋酸,用右图装置完成表中实验,回答下列问题。
![]()
实验序号 | ① | ② | ③ | ④ |
实验温度/℃ | 25 | 25 | 70 | 70 |
试剂 | 稀氨水 | 稀醋酸 | 稀氨水 | 稀醋酸 |
出现铁锈 所需时间 | 1天 未见锈蚀 | 5分钟 | 1天 未见锈蚀 | 1分钟 |
(1)铁锈的主要成分是________(填化学式)。
(2)实验②和④可探究________因素对铁制品锈蚀快慢的影响;欲探究试剂酸碱性对铁制品锈蚀快慢的影响,应选择的实验是______________(填实验序号)。
(3)根据表中实验现象得出的结论是_________________(写出1点即可)。
(4)影响铁制品的锈蚀快慢除上述因素外,还有______________________(写出1点即可),请设计实验方案_________________________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同.
①下表是KNO3、NaCI在不同温度下的溶解度(单位:g/100g水).
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCI | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
Ⅰ.上表中的两种物质在40℃时,________的溶解度较大;请用相应的数据列式表示该温度时KNO3饱和溶液的质量分数________ (不要求计算).
Ⅱ.请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法________ .
Ⅲ.20℃时,将20g NaCl放入50g水中,所得溶液的质量是________ g.
Ⅳ.从NaCl溶液中得到NaCl晶体的方法是________ .
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).
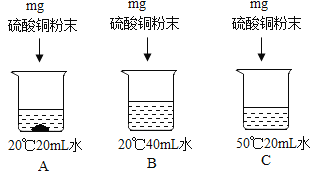
所得三个溶液中:一定属于饱和溶液的是________ ,溶液中溶剂质量的大小关系是________ .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某不纯的氯化钠样品中只含有一种杂质,取该样品11.7克,溶于适量水中,然后加入足量的硝酸银溶液,得到29.7克白色沉淀,则所含杂质不可能是( )
A. 氯化镁 B. 氯化钙 C. 氯化铝 D. 氯化钾
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,氯酸钾的溶解度较小,在工业上可通过如下转化制得。
![]()
(l)实验室用KClO3制取氧气的化学方程式为______________。
(2)反应I中,通电时发生的反应方程式为NaCl+3X===NaClO3+3H2↑,则X的化学式为_____。
(3)反应Ⅱ的基本反应类型为_____。
(4)该转化中可以循环利用的物质是_____(填名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com