
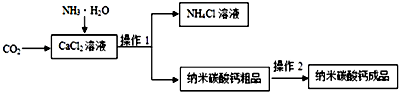
分析 (1)根据方程式的写法考虑;(2)根据液体与固体分离的方法考虑,根据过滤操作用到的仪器考虑玻璃仪器;根据操作Ⅰ分离的两种物质考虑表面可能含有的可溶性杂质,根据使纳米碳酸钙粗品除杂质及检验是否除尽考虑;(3)根据副产品的组成和用途考虑.
解答 解:(1)生成CaCO3固体的反应物是氯化钙、氨水、二氧化碳,生成物是碳酸钙、氯化铵和水,用观察法配平,碳酸钙后面标上沉淀符号;
(2)碳酸钙粗品属于固体不溶物,氯化铵溶液属于液体,把不溶于液体的固体和液体分离的方法就是过滤,过滤用到的仪器有:铁架台、漏斗、烧杯、玻璃棒,所以玻璃仪器有:漏斗、烧杯、玻璃棒;由于碳酸钙粗品是从氯化钙溶液中过滤出来的,所以表面可能含有的可溶性杂质是氯化铵,如果氯化钙溶液过量的话,表面可能含有氯化钙;把碳酸钙粗品表面含有的可溶性杂质氯化铵除掉的方法是用水清洗,检验是否还含有氯化铵,可以利用检验氯离子,使用硝酸银,硝酸银能与氯化铵反应生成氯化银沉淀,有沉淀说明没除净,没有沉淀说明除净了;
(3)流程中的副产品是氯化铵,氯化铵属于氮肥,可以做肥料,氯化铵与氢氧化钠反应产生氨气,显碱性,能使红色石蕊试纸变蓝;铵态氮肥不能和碱性肥料混合使用,否则会产生氨气,降低肥效.
故答案为:(1)2NH3•H2O;2NH4Cl;(2)过滤; 玻璃棒;漏斗;加水清洗;②;(3)氮肥(化肥、肥料);蓝;碱性;产生氨气,降低肥效.
点评 解答本题关键是要熟悉方程式的写法,过滤操作能达到的目的,熟悉过滤操作中使用的仪器,知道氯离子的检验方法和氯化铵的用途.


 备战中考寒假系列答案
备战中考寒假系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 4:1 | B. | 2:3 | C. | 1:2 | D. | 1:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
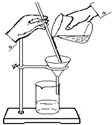 过滤是除去液体中不溶性固体的一种方法.利用它可将不溶于液体的固体和液体进行分离.
过滤是除去液体中不溶性固体的一种方法.利用它可将不溶于液体的固体和液体进行分离.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物 质 | 选用的方法或试剂 | |
| A | 二氧化碳和氮气 | 燃着的木条 |
| B | 二氧化锰和木炭 | 看颜色 |
| C | 氧气和二氧化碳 | 通入澄清石灰水 |
| D | 硬水和软水 | 加入肥皂水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com