
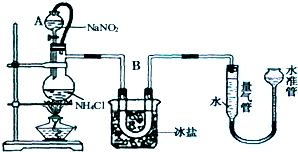
分析 方法二:根据实验的要求要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂完成;(根据制取气体时需要检查装置气密性考虑;
【实验探究】
①该反应为制取氮气的反应,所以需装置不漏气,实验前需检查装置的气密性;
【实验分析及数据处理】
(1)根据制取氮气的反应所需装置的特点解答;
(2)根据实验室用饱和NaNO2和NH4Cl溶液反应制取氮气的反应为放热反应考虑;
(3)根据氯化铵的质量算出生成氮气的质量,再除以氮气的体积;
【解释与结论】根据方法二得到的氮气不纯进行考虑.
【反思与评价】
(1)因为制取氮气的反应是放热反应,蒸馏瓶内气体膨胀,压强会增大,使长颈漏斗中的液体不容易滴下;
(2)科学家瑞利仅仅是从小数点第三位数的差别,所以我们应学习科学家严谨的态度.
解答 解:方法二:空气中除了氮气、氧气外,还含有二氧化碳、水蒸气等,为保证所得氨气尽可能纯净,要除去空气中多余的水蒸气、二氧化碳等杂质,可以通过碱性干燥剂-碱石灰,既可以吸收二氧化碳又能吸收水;
【实验探究】
①该反应为制取氮气的反应,所以需装置不漏气,实验前需检查装置的气密性;
【实验分析及数据处理】
(1)该反应为制取氮气的反应,所以需装置不漏气,实验前需检查装置的气密性;
(2)NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O+Q,该反应为放热反应,所以加热片刻后,即应移去酒精灯以防反应物冲出;
(3)设反应生成N2的质量为x
NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+N2↑+2H2O
53.5 28
0.21g x
$\frac{53.5}{28}$=$\frac{0.21g}{x}$
解得x=0.11g;
生成氮气的体积为:100ml-12ml=88ml=0.088L
生成氮气的密度为:$\frac{0.11g}{0.088L}$=1.25g/L;
【解释与结论】
将空气通过灼热的铜,得到较纯净的氮气和氧化铜粉末只是除去了氧气,其中还含有稀有气体等杂质,由于稀有气体的密度比氮气密度大,所以导致氮气密度总是偏大5‰左右.
【反思与评价】
(1)装置中A部分的分液漏斗与蒸馏瓶之间连接的导管所起的作用是使NaNO2饱和溶液容易滴下,因为该反应放热,增加蒸馏瓶内压强,不用导管时长颈漏斗内的液体不能滴入蒸馏瓶中.
(2)科学家瑞利仅仅是从小数点第三位数的差别,所以我们应学习科学家严谨的态度.
答案:
【方法二】E;碱石灰;
【实验探究】
①检查装置的气密性;
【实验分析及数据处理】
(1)检查装置的气密性;(2)防反应物冲出;(3)0.11g;1.25g/L
【解释与结论】
方法二制得的氮气中含有密度比氮气大的稀有气体,导致密度偏大;
【反思与评价】
(1)C;(2)AC.
点评 本题是一信息题,考查学生的知识拓展迁移能力,要求学生有良好的分析能力,能会从题干信息中找突破口,根据信息将学过的知识进行迁移


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 试剂 |
| A | K2SO4溶液 | (NH4)2SO4 | KOH溶液 |
| B | CaO固体 | CaCO3 | 稀HCl |
| C | CO2气体 | HCl | NaOH溶液 |
| D | FeSO4溶液 | CuSO4 | Mg粉 |
| A. | A | B. | B | C. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 用铂丝蘸取该固体在酒精灯上灼烧. | 火焰呈黄色 | 固体中含有Na+. |
| ② | 将该固体置于足量蒸馏水中. | 固体全部溶解. | 固体可溶于水. |
| ③ | 取少量②所得溶液,向其中滴加紫色石蕊试液,并振荡. | 溶液变蓝. | 溶液为碱性. |
| ④ | (此格不必填写) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
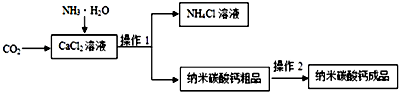
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
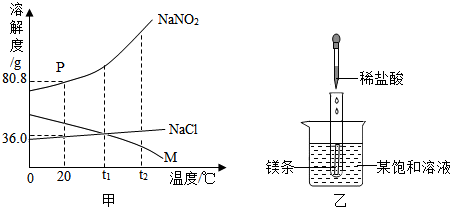
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com