
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ① | 用铂丝蘸取该固体在酒精灯上灼烧. | 火焰呈黄色 | 固体中含有Na+. |
| ② | 将该固体置于足量蒸馏水中. | 固体全部溶解. | 固体可溶于水. |
| ③ | 取少量②所得溶液,向其中滴加紫色石蕊试液,并振荡. | 溶液变蓝. | 溶液为碱性. |
| ④ | (此格不必填写) |
分析 【得出结论】:根据固体酒精若是固态的酒精的话,在常温下将是液态,因为酒精的熔点是-114.1℃进行解答;
【实验探究Ⅱ】:要证明氢氧化钠存在的方法是测定溶液显碱性,碳酸钠溶液也显碱性,所以要先证明碳酸钠的存在,并且把碳酸钠除去,再证明氢氧化钠的存在;
实验结论:根据碳酸钠和氯化钙反应生成碳酸钙沉淀,氢氧化钠溶液呈碱性进行解答;
【联想与解释】根据钠离子燃烧时火焰呈黄色进行解答.
解答 解:【得出结论】:酒精的熔点为-114.1℃,即在常温下,酒精不可能为固态,所以固体酒精不是固态的酒精;故填:酒精的熔点为-114.1℃,即在常温下,酒精不可能为固态;
[实验探究Ⅱ]:氢氧化钠溶液显碱性,通过测定溶液显碱性来确定氢氧化钠的存在.碳酸钠溶液也显碱性,会干扰氢氧化钠的检验,所以应先检验碳酸钠的存在,并将其除去,检验碳酸根离子用钙离子,但不能混入氢氧根离子,可用过量的氯化钙溶液,或硝酸钙溶液.故答案为
| 序号 | 实验步骤 | 实验现象 | 实验结论 |
| ④ | 取少量①所得溶液放入试管中,滴加过量氯化钙溶液,待充分反应后,滴加数滴无色酚酞试液. | 有白色沉淀生成, 溶液变红 | (此格不须填写) |
点评 检验混合物中的多种物质时,要注意检验的顺序,同时要把影响后面物质检验的物质除去.


科目:初中化学 来源: 题型:解答题

| 序号 | 实验操作 | 主要实验现象 | 实验结论和解释 |
| ① | 打开a,关闭b,由长颈漏斗注入稀盐酸 | A中产生大量气泡 E中出现浑浊 | E中反应的化学方程式为CO2+Ca(OH)2=CaCO3↓+H2O |
| ② | 当E中出现浑浊时,打开b,关闭a,点燃酒精灯 | D中Na剧烈燃烧,产生白烟内壁附着黑色、白色固体; G中产生黑色沉淀 | 反应产物一定有C和CO |
| ③ | 取D中白色固体于试管中,加水溶解,再加入石灰水 | 产生白色沉淀 | 反应产物还有Na2CO3;反应的方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 氧气约占空气总体积的$\frac{1}{5}$ | |
| B. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要 | |
| C. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| D. | 夏天鱼池内需要增氧,是因为温度升高,氧气在水中的溶解度减小 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
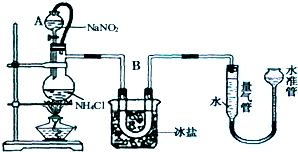
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某同学在一次玩耍中,偶然发现竹子浸没水中后,在竹子上打一小洞,会看到水中有很多小气泡冒出.
某同学在一次玩耍中,偶然发现竹子浸没水中后,在竹子上打一小洞,会看到水中有很多小气泡冒出.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com