
【题目】为探究酸的化学性质,实验小组设计了如下实验:
回答下列相关问题。
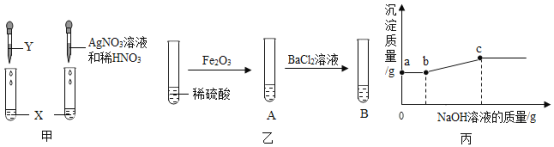
(1)按图甲实验,可确定X是盐酸,则Y可以是____(选填“石蕊”或“酚酞”)溶液;
(2)由图乙实验,A中固体全部溶解,B中有白色沉淀产生,得出结论:A中溶质只有Fe2(SO4)3。有同学认为该结论不合理,接着向试管B中滴加NaOH溶液,且产生沉淀的量随NaOH溶液的量的关系如图丙所示,则正确结论是:A中溶质有____。实验中,ab段对应溶液中一定发生反应的化学方程式为____,分别列出c点对应溶液中所含溶质的所有可能情况____;
(3)由以上实验可知,酸能和____(填数字)类物质发生化学反应。
【答案】石蕊 H2SO4、Fe2(SO4)3 NaOH+HCl=NaCl+H2O NaCl;NaCl、BaCl2;NaCl、Na2SO4 4
【解析】
(1)检验物质按图甲实验,可确定X是盐酸,则Y可以是紫色石蕊试液,这是因为稀盐酸能使石蕊试液变红色,而不能使无色酚酞变色;
(2)①接着向试管B中滴加氢氧化钠溶液时,一段时间内不产生沉淀,说明溶液中含有硫酸,氢氧化钠先和硫酸反应生成硫酸钠和水,则A中溶质有Fe2(SO4)3、H2SO4;
②a-b段对应溶液中一定发生的反应是:氯化钡和稀硫酸反应生成的盐酸和氢氧化钠反应生成氯化钠和水,反应的化学方程式为:NaOH+HCl=NaCl+H2O;
③当氯化钡、硫酸铁、稀硫酸恰好完全反应时,溶质只有NaCl;当氯化钡过量时溶质是NaCl 和BaCl2;当硫酸过量时溶质是NaCl、Na2SO4;
(3)由以上实验总结酸的化学性质有:酸能与酸碱指示剂、某些金属氧化物、碱、某些盐反应,因此酸能和4类物质发生化学反应。


科目:初中化学 来源: 题型:
【题目】镁能与NH4Cl溶液反应,不仅生成一种盐,还有气泡产生。为确定气体的成分,某化学兴趣小组的同学进行下列实验探究。
(提出问题)镁能与NH4Cl溶液反应生成何种气体?
(猜想与假设)甲同学认为生成的气体可能是SO2、HCl、NH3、H2中的一种或几种
(1)乙同学很快认为生成的气体不可能含有SO2的理论依据是__________。
(2)丙同学认为生成的气体不可能含有HCl,其原因是__________。
(进行实验)经过讨论认为:该气体可能含有NH3和H2或NH3,他们设计如图所示装置进行实验。

(现象与结论)
(3)A中观察到_____,证明生成气体含有NH3。B装置中浓硫酸的作用除了干燥气体外,还可以________。C中有肥皂泡飘到空中,用燃着的木条靠近肥皂泡,有爆呜声,说明生成的气体还含有_________.
(实验反思)
(4)写出Mg与NH4Cl溶液反应的化学方程式__________.
(5)氨气极易溶于水,上述实验中有氨气逸出的原因可能是__________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~G表示初中化学常见的物质,其中C是大理石的主要成分,各物质间相互转化关系如图所示.请回答下列问题:
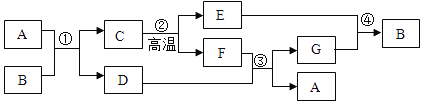
(1)B的化学式为_____;反应④属于化学基本反应类型中的_____.
(2)A是一种常见的钠盐,它的一种俗称是_____;说出它一条用途_____;反应②的化学方程式为_____.反应③的化学方程式为_____.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
(查阅资料)
①无水硫酸铜是白色固体,吸水变蓝。
②生产原料粗盐中含有少量可溶性杂质(![]() 和
和![]() )及不溶性杂质,生产过程中需先将粗盐精制。
)及不溶性杂质,生产过程中需先将粗盐精制。
③生产原理:![]() 。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
。分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
④氯化铵分解的化学方程式是:![]() 。
。
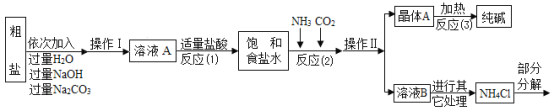
⑤部分生产流程如图所示:
(问题讨论)
(1)①写出加入NaOH溶液所发生反应的化学方程式________。
②反应(1)中加入适量盐酸的目的是________。
(2)上述生产流程中可循环使用的物质是________(填字母)。
A![]() B NaOH C HCl D
B NaOH C HCl D![]()
(组成探究一)
(3)①晶体A受热分解的化学方程式为________。
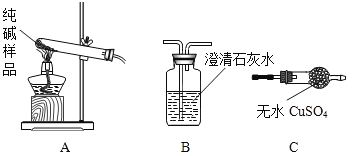
②设计实验检验纯碱样品中是否混有晶体A,请完成下表(装置从下图中选择)
选择的装置 | 实验现象 | 实验结论 |
________(填字母) | ________ | 样品不含晶体A |
(组成探究二)
(4)取纯碱样品加水溶解,向该溶液中加入过量稀![]() ,再滴加
,再滴加![]() 溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
溶液,有白色沉淀。产生沉淀的化学方程式为________,由此确定纯碱样品含有杂质NaCl。
(组成探究三)
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:
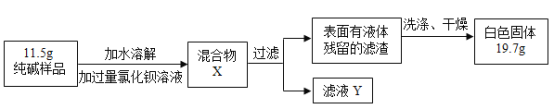
①氯化钡溶液过量的目的是________。判断氯化钡已过量的方法是________。
②判断滤渣是否洗净的方法是:取最后一次洗涤液少许于试管中,滴加________,若无沉淀产生,则已洗净。
③根据实验数据,计算样品中碳酸钠的质量分数为________(列出计算过程,保留一位小数)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】河南叶县的粗盐中含有![]() 、
、![]() 、
、![]() 以及泥沙等杂质以下是一种制备精盐的实验方案(用于沉淀的试剂均过量)请回答下列问题:
以及泥沙等杂质以下是一种制备精盐的实验方案(用于沉淀的试剂均过量)请回答下列问题:
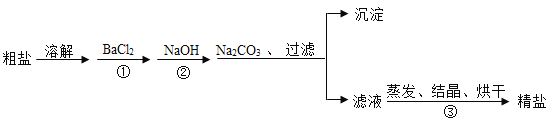
(1)碳酸钠的作用:________;
(2)①步骤中所发生的反应方程式:_____________;
(3)请设计实验证明滤液中的成分_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向盛有等质量、等溶质质量分数的稀硫酸的三支试管中,分别加入足量的Mg、Fe、Zn三种金属粉末,其发生反应的质量关系如图所示。请认真读图并判断下面分析不合理的是
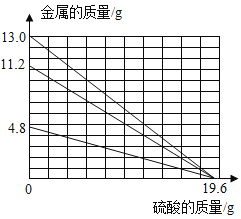
A.反应速率:Mg>Fe>Zn
B.反应生成等质量的氢气
C.Zn反应后所得溶液溶质质量分数最大,Mg反应后所得溶液溶质质量分数最小
D.若将上述三只试管中的稀硫酸换成等质量、等溶质质量分数的硫酸铜溶液,也分别加入足量的Mg、Fe、Zn三种金属粉末,反应生成等质量的铜且消耗金属Mg、Fe、Zn的质量比值是:24:56:65
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4以及一定量的CuSO4和Na2SO4。为减少污染并将其变废为宝,某学习小组设计以下流程,拟从该废水中回收硫酸亚铁、金属铜,并利用氨碱法原理“制碱”。(除标注外,其余所加药品或试剂均过量,部分产物及反应条件略去)请根据图示回答下列问题:
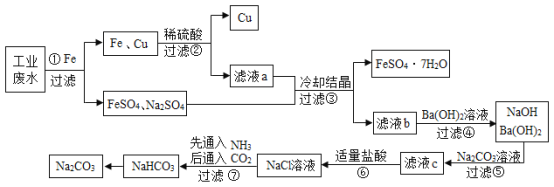
(1)由步骤①可知的金属活动性Fe比Cu___(选填“强”或“弱”)。在步骤①中向废水中加入过量的铁粉,过量的目的是______________。
(2)若向步骤②所得滤液a中滴加几滴紫色石蕊试液,溶液呈____色。
(3)步骤⑤中加入Na2CO3溶液的作用是___________________。
(4) “NaCl+CO2+NH3+H2O= NaHCO3+NH4Cl”是氨碱法制纯碱中重要的反应。
①将氨气通入饱和食盐水中,可制成饱和氨盐水(氨气极易溶于水)。氨盐水比食盐水更容易吸收二氧化碳的原因是:_________________。
②氨盐水吸收二氧化碳生成碳酸氢钠和氯化铵两种物质,更易析出的是NaHCO3,原因是_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】AgNO3、Cu(NO3)2、Al(NO3)3的混合溶液中加入一定量的锌粉和铁粉并充分反应,过滤得滤渣和滤液。往滤渣中加盐酸,若无明显现象,则反应后滤液中一定含有的溶质是____,反应的化学方程式为____(写一个即可);若往滤渣中加盐酸,有气泡产生,则滤渣中一定有的是_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为测定镁和硫酸镁固体混合物中镁元素的质量分数,先称取5g混合物,放入一干净的烧杯中,然后取50g某溶质质量分数的稀硫酸,平均分五次加入其中,充分反应,实验所得数据如下表:
第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
加入稀硫酸的质量/g | 10 | 10 | 10 | 10 | 10 |
生成气体的总质量/g | 0.05 | m | 0.15 | 0.18 | n |
(l)上表中m=_____、n=_____.
(2)请计算所用稀硫酸的溶质质量分数(结果保留一位小数).____
(3)固体混合物中,硫酸镁的质量分数为_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com