
分析 【实验设计】
甲方案:根据样品中碳酸钠与石灰水反应写出反应的化学方程式,由生成沉淀碳酸钙的质量,求出碳酸钠的质量,再计算样品中碳酸钠的质量分数;
乙方案:(1)根据碳酸钠与硫酸的反应,当a、b的质量关系等于碳酸钠与二氧化碳的质量比时碳纯碱样品中只含有碳酸钠碳酸钠;
(2)根据碳酸钠与硫酸的反应,由二氧化碳的质量求出碳酸钠的质量,再计算出样品中碳酸钠的质量分数.
【交流反思】
(1)根据玻璃棒的作用分析;
(2)通过洗涤,可以除去沉淀表面杂质,减少误差;
(3)根据稀释浓硫酸的操作分析回答.
解答 解:【实验设计】甲方案:
设纯碱样品中含Na2CO3的质量为x
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
106 100
x 10.00g
$\frac{106}{100}=\frac{x}{10.00g}$ 解得:x=10.60g
纯碱样品中Na2CO3的质量分数为:$\frac{10.6g}{13.25g}$×100%=80%
乙方案:由Na2CO3与硫酸的反应:
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 44
(1)当a、b的质量关系满足$\frac{a}{b}=\frac{53}{22}$时,纯碱样品中只含有碳酸钠,样品中碳酸钠的质量分数是100%.
(2)设纯碱样品中碳酸钠的质量为y
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 100
y bg
$\frac{106}{44}=\frac{y}{bg}$ 解得:y=$\frac{106bg}{44}$
样品中碳酸钠的质量分数是:$\frac{\frac{106b}{44}}{ag}×100%$=$\frac{53b}{22a}$×100%.
【交流反思】
(1)甲方案实验过程中,需用玻璃棒不断搅拌,该操作的目的是使反应充分进行.
(2)甲方案实验操作中,过滤操作需要的玻璃仪器有漏斗、烧杯、玻璃棒,对沉淀洗涤的目的是:洗去附着在沉淀表面的可溶性杂质,以免对实验结果造成误差.
(3)乙方案中,需用一定质量的19.6%的稀硫酸.用98%的浓硫酸(密度为1.84g/cm3),配制乙方案中实验所用稀硫酸的正确操作是把浓硫酸沿器壁慢慢注入水里,并不断搅拌.
故答为:甲方案:80%,Na2CO3+Ca(OH)2═CaCO3↓+2NaOH.
乙方案:(1)$\frac{a}{b}=\frac{53}{22}$;(2)$\frac{53b}{22a}$×100%;Na2CO3+H2SO4═Na2SO4+CO2↑+H2O.
【交流反思】
(1)使反应充分进行; _.
(2)漏斗、烧杯、玻璃棒,洗去附着在沉淀表面的可溶性杂质,以免对实验结果造成误差.
(3)把浓硫酸沿器壁慢慢注入水里,并不断搅拌.
点评 本题将计算和实验有机地结合起来进行考查,通过认证审题,结合题干中已给出一系列的提示,根据提出的问题,发现有用的信息,充分发挥联想,与已有的知识建立联系,然后进行类比推导,从而达到解决问题的目的.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
| 3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
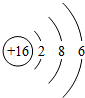 ,该元素的原子核外有3个电子层,其化学性质比较活泼,在化学反应中易得(填“得”、“失”)电子.
,该元素的原子核外有3个电子层,其化学性质比较活泼,在化学反应中易得(填“得”、“失”)电子.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢 | |
| B. | 根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行 | |
| C. | 根据溶解度曲线图,判断从溶液中获得晶体的方法 | |
| D. | 根据相对原子质量表判断原子内部结构及元素在元素周期表中的位置 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
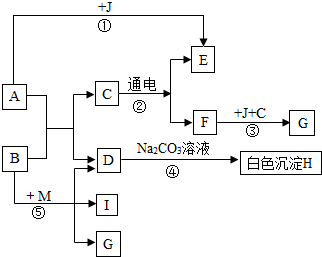 框图中A是人体胃液中含有的成分,B常用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•XH2O),E、F、I为无色气体.根据图示回答下列问题.
框图中A是人体胃液中含有的成分,B常用于改良酸性土壤,G是铁锈的主要成分(Fe2O3•XH2O),E、F、I为无色气体.根据图示回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 该白色粉末一定不含硫酸铜和氢氧化钠 | |
| B. | 该白色粉末一定含有硫酸钠、硝酸钡和碳酸钠 | |
| C. | 若向所得沉淀中滴加稀硝酸,沉淀部分溶解;则白色粉末一定只含有硝酸钡、碳酸钠和硫酸钠 | |
| D. | 若向所得沉淀中滴加稀硝酸,沉淀全都不溶解;则白色粉末一定含有硝酸钡、硫酸钠,一定不含碳酸钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com