
| A. | 根据金属活动性顺序表,判断金属能否置换出稀硫酸中的氢 | |
| B. | 根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行 | |
| C. | 根据溶解度曲线图,判断从溶液中获得晶体的方法 | |
| D. | 根据相对原子质量表判断原子内部结构及元素在元素周期表中的位置 |
分析 A、根据金属与稀硫酸反应的条件限制来考虑本题;
B、根据复分解反应能否发生的条件考虑;
C、根据从溶液中获得晶体的方法来考虑;
D、根据相对原子质量等于质子数与中子数之和考虑.
解答 解:A、根据金属活动性顺序表,排在氢前面的金属能置换出酸中的氢,使用正确;
B、复分解反应发生的条件是生成物中有沉淀、气体或水生成,故根据溶解度曲线图,可判断有无沉淀生成,故使用正确.
C、根据溶解度曲线图,溶解度受温度影响较大和不大的物质,可以分别采用降温结晶和蒸发结晶的方法结晶,使用正确;
D、根据相对原子质量不能确定原子内部结构,故使用不正确;
故选D.
点评 通过回答本题要知道金属活动性顺序表只能判断一部分金属能否与酸反应,熟记复分解反应发生的条件,只要符合一个条件就行,但需要注意的是碱与盐反应或盐和盐反应时,反应物必须溶于水,再考虑复分解发生的条件.


科目:初中化学 来源: 题型:选择题
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | HCl+NaOH═NaCl+H2O | D. | 2H2S+SO2═3S↓+2H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 事实 | 解释 | |
| A | 墙内开花墙外香 | 分子不断运动 |
| B | CO难溶于水,剧毒;CO2可溶于水,无毒 | 物质结构决定物质性质 |
| C | FeCl3溶液呈黄色,NaCl溶液呈无色 | 两种溶液中的阳离子不同 |
| D | 温度计中的水银(汞)柱受热升高,遇冷下降 | 原子的大小发生改变 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
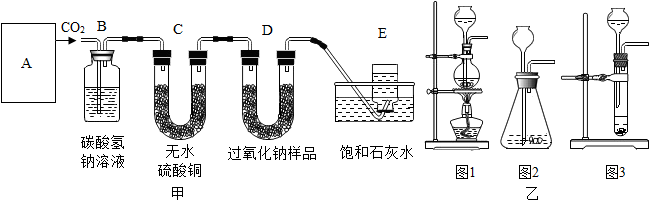
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 200g | B. | 100g | C. | 50g | D. | 25g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com