
| 第一次 | 第二次 | 第三次 | |
| 所取固体混合物的质量/g | 10 | 10 | 15 |
| 所用稀盐酸的质量/g | 60 | 70 | 50 |
| 生成CO2的质量/g | 3.3 | 3.3 | 3.3 |
| 84 |
| 44 |
| x |
| 3.3g |
| 58.5 |
| 44 |
| y |
| 3.3g |
| 36.5 |
| 44 |
| z |
| 3.3g |
| 6.3g |
| 10g |
| 2.7375g |
| 50g |
| 4.3875g+(10g-6.3g) |
| 10g+50g-3.3g |


 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 选择的装置 | 实验现象 | 实验结论 |
AB”或“AC”或“ACB AB”或“AC”或“ACB |
“B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” “B不变浑浊”或“C不变蓝”或“C不变蓝、B不变浑” |
样品不含晶体A |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
| 106 |
| X |
| 197 |
| 19.7g |
| 10.6g |
| 12.0g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 NH3↑+HCl↑.
NH3↑+HCl↑.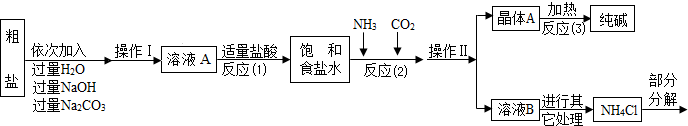
| 选择的装置 | 实验现象 | 实验结论 |
| ______ | ______ | 样品不含晶体A |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
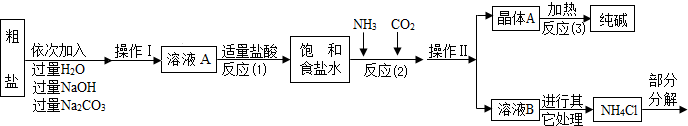
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究。
【查阅资料】
①生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质。
②生产原理反应⑵:NaCl+ NH3 + CO2 + H2O= NaHCO3↓+ NH4Cl,分离得晶体A,并使其充分受热,可分解制得纯碱及两种常见的氧化物。
③氯化铵分解的化学方程式是NH4Cl △ NH3↑+HCl↑。
④部分生产流程如下图所示:
 |
(1)①溶液A中的溶质有NaCl和 、 ,②操作Ⅱ的名称为 。
③流程中NaOH溶液的作用是除去粗盐中的 。
④写出加入Na2CO3溶液所发生反应的化学方程式 。
(2)上述生产流程中可循环使用的是 (填序号)。
A.CO2 B.NH3 C.HCl D.NaOH
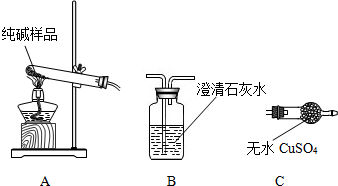
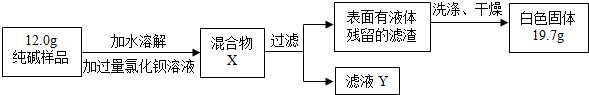
【组成探究一】(3)①晶体A受热分解的化学方程式为 。
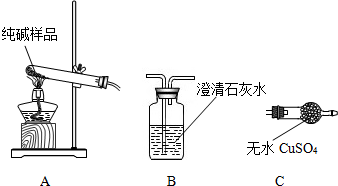
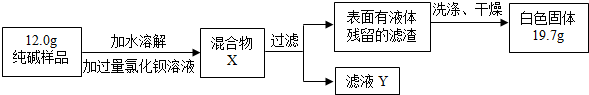
②设计实验检验纯碱样品中是否混有晶体A,请完成下表:
【组成探究二】(4)取纯碱样品加水溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀。产生沉淀的方程式为 ,由此确定纯碱样品含有杂质NaCl。

| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |
【组成探究三】(5)同学们为了测定该纯碱样品的纯度,设计了如下实验: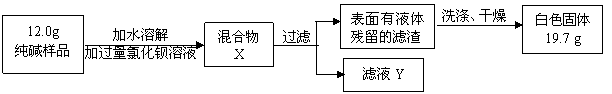
①判断加入氯化钡溶液是否过量的合适方法是 ,然后观察现象判断。
A.静置混合物X,向上层清液中再滴少许氯化钡溶液 B.向滤液Y中滴加少许氯化钡溶液
②判断滤渣是否洗涤干净,可以采取向最后的洗出液中滴加 ,然后观察现象判断。
A.氯化钡溶液 B.稀硫酸 C.碳酸钠溶液 D.稀盐酸
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程。4分)
[Mr(BaCl2)=208 Mr(Na2CO3)=106 Mr(BaCO3)=197 Mr(NaCl)=58.5]
查看答案和解析>>
科目:初中化学 来源:2012年江苏省扬州市仪征市中考化学二模试卷(解析版) 题型:填空题
 NH3↑+HCl↑.
NH3↑+HCl↑.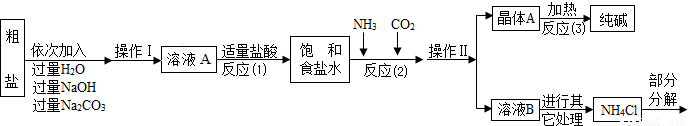
| 选择的装置 | 实验现象 | 实验结论 |
| 样品不含晶体A |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com