
【题目】工业上常利用电石制乙炔气体![]() 时产生的灰浆和残渣制备化工原料
时产生的灰浆和残渣制备化工原料![]() 和超细
和超细![]() .
.
![]() 电石制乙炔气体
电石制乙炔气体![]() 时产生灰浆和残渣的过程如下:电石
时产生灰浆和残渣的过程如下:电石![]() 灰浆
灰浆![]() 残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是
残渣,其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式 ______,残渣中主要成分是![]() 和 ______ .
和 ______ .
Ⅰ![]() 制备
制备![]() 的流程如图:
的流程如图:
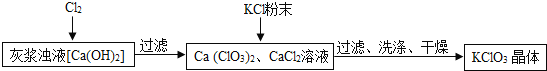
![]() 向灰浆浊液中通入
向灰浆浊液中通入![]() ,得到
,得到![]() 、
、![]() 溶液.反应中
溶液.反应中![]() 与
与![]() 的化学计量数分别为1和
的化学计量数分别为1和![]() 写出此反应的化学方程式 ______ .
写出此反应的化学方程式 ______ .
![]() 有关物质在常温下的溶解度如下:
有关物质在常温下的溶解度如下:
物质 |
|
|
| KCl |
溶解度 |
|
|
|
|
上述流程中加入KCl粉末,KCl与 ______ ![]() 填化学式
填化学式![]() 发生了复分解反应,得到
发生了复分解反应,得到![]() 晶体.你认为能得到
晶体.你认为能得到![]() 晶体的原因是 ______ .
晶体的原因是 ______ .
![]() 洗涤时,可选用下列洗涤剂 ______
洗涤时,可选用下列洗涤剂 ______ ![]() 填字母编号
填字母编号![]() .
.
A KCl饱和溶液![]() 冰水
冰水![]() 饱和
饱和![]() 溶液
溶液
Ⅱ![]() 制备超细
制备超细![]() 的流程如下
的流程如下![]() 注:加入
注:加入![]() 溶液的目的是溶解残渣中的难溶盐
溶液的目的是溶解残渣中的难溶盐![]() :
:
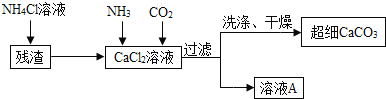
![]() 向
向![]() 溶液中通入两种气体,生成超细
溶液中通入两种气体,生成超细![]() 的化学方程式 ______
的化学方程式 ______ ![]() 检验
检验![]() 是否洗涤干净的方法是 ______ .
是否洗涤干净的方法是 ______ .
![]() 流程中溶液A可循环使用,其主要成分的化学式是 ______ .
流程中溶液A可循环使用,其主要成分的化学式是 ______ .
【答案】CaC2+2H2O=Ca(OH)2+C2H2↑ CaCO3 6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O Ca(ClO3)2 KClO3在常温下溶解度较小 BC CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl 取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净 NH4Cl
【解析】
(1)电石与水反应生成氢氧化钙和乙炔,化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,其露置在空气中,会与空气中的二氧化碳反应生成碳酸钙,所以残渣中主要成分是Ca(OH)2和CaCO3;
(2)由题意可知反应物为氯气和氢氧化钙,生成物为Ca(ClO3)2、CaCl2和H2O,反应的化学方程式为:6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O;
(3)由表以及复分解反应的定义,两种化合物相互交换成分可知,KCl与Ca(ClO3)2发生了复分解反应,由于KClO3在常温下溶解度较小,所以可结晶析出,得到其固体;
(4)B和C都可以洗涤氯酸钾晶体,但A不可,因为它会引入新的杂质;
(5)由流程图可以看出,反应物为氨气和二氧化碳和氯化钙和水,生成物为碳酸钙和氯化铵,其反应的化学方程式为:CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl,氯离子和银离子会生成氯化银沉淀,所以检验CaCO3是否洗涤干净的方法是:取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净;
(6)由(5)中的化学方程式可以得知,A溶液的化学式为:NH4Cl.
故答案为:
(1)CaC2+2H2O=Ca(OH)2+C2H2↑;CaCO3;
(2)6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O;
(3)Ca(ClO3)2;KClO3在常温下溶解度较小;
(4)BC;
(5)CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl;取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净;
(6)NH4Cl.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:
【题目】氨气(NH3)是一种无色、有刺激性气味的气体,极易溶于水,它的水溶液称为氨水。氨在化学工业上用途很广泛,例如制化肥、制纯碱等;近年来,氨还被用来进行环境治理。请回答下列问题:
(1)氨气中氮元素与氢元素的质量比为________.
(2)我国著名的化学家候德榜教授,是我国制碱工业的先驱和奠基人,他发明了“侯氏制碱法”。其中关键的一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+A,其生成物A也可用作化肥,50kgA中含氮元素______kg。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是三种物质的溶解度曲线.下列说法错误的是( )
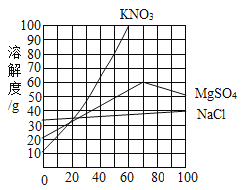
A.升高温度,可以使三种物质的溶解度增大
B.降低温度.可以除去饱和KNO3溶液中含有的少量NaCl
C.50℃时,三种物质的溶解度由大到小的顺序是:KNO3>MSO4>NaCl
D.50℃时,三种饱和溶液降温至10℃,所得溶液溶质的质量分数由大到小的顺序是:NaCl>MgSO4>KNO3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国女科学家屠呦呦发现青蒿素,并于2015年获得诺贝尔医学奖.已知青蒿素的化学式为C15H2205,它是一种用于治疗疟疾的药物.
(1)青蒿素分子由_____种元素构成,一个青蒿素分子含有_____个原子.
(2)青蒿素分子中C、H、O三种元素的质量比为_____.
(3)24g青蒿素中所碳元素的质量为_____ g.(计算结果精确到一位小数)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化工厂有甲、乙两个车间,它们排放的废水中均含三种离子,经分析这些离子是Ba2+、Cu2+、K+、NO3﹣、SO42﹣、CO32﹣。甲车间废水呈碱性,若将甲、乙车间的废水按适当比例混合,使废水中的某些离子恰好完全反应转化为沉淀(如图所示)。下列分析正确的是( )
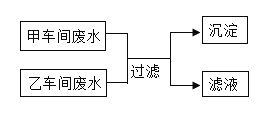
A.甲车间的废水含有的离子是K+、CO32﹣、NO3﹣
B.图中的沉淀是硫酸钡和碳酸钡
C.图中滤液所含阳离子与阴离子的数目比为1:1
D.若向乙车间的废水中加入适量铁粉,充分反应后过滤,滤液可直接排放
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小金制作了一个如图甲所示的简易酸碱灭火器,并进行了如图乙所示的灭火操作,结束后对瓶中残留液进行了如下实验:①取少量残留液于试管中,滴加2滴紫色石蕊试液,变红色;②另取少量残留液于试管中滴加适量氯化钡溶液,有白色沉淀,则残留液中有大量的( )

A.硫酸钠 B.碳酸钠 C.盐酸 D.氯化钠
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硫酸铜晶体常用作农业和渔业的杀虫剂、杀菌剂。以下是由废铜料(含铁)生产硫酸铜晶体的流程。

(1) B的化学式为________,操作a的名称是________。
(2)②的反应基本类型为___________;反应①、③的化学方程式分别为①______________;③______________。
(3)已知:![]() 从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和_______________。
从环保和经济的角度分析,对比途径I、Ⅱ,途径I的优点有:不产生有害气体和_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】以下是初中化学一些常见物质间互相转化的关系图(有些反应条件已省略):已知高温下CO能与多种金属氧化物反应生成相应的金属和CO2.下列关系图中A、B、X、Y均为无色气体,甲、乙、丙均为黑色固体,E、F为常见金属.

请回答:
(1)A的名称为___;蓝色溶液中溶质的化学式为___.
(2)生成固体甲的化学方程式为___.
(3)固体乙与丙反应的化学方程式为___.
(4)写出图中属于复分解反应的化学方程式___.
(5)固体乙与X的反应,说明X具有___性.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】肥料是农业生产中必不可少的,已知某氮肥溶液可能是氯化铵、碳酸铵、硫酸铵、尿素中的一种或几种,现要检验其成分,进行如下实验:
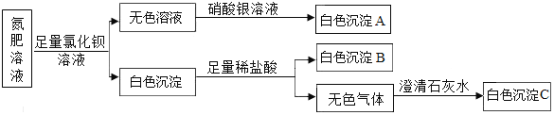
(1)写出产生沉淀C的化学方程式___________。
(2)通过以上实验分析,该氮肥溶液中一定含有哪些物质___________?
(3)选用哪种试剂代替氯化钡溶液,能检测出可能含有的一种氮肥是否存在___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com