
【题目】2018年4月美国对中国企业中兴通讯禁售手机芯片等,芯片的制造引起了热议,而制造芯片的主要原材料是高纯硅。高纯硅制备方法之一的工业流程如下:
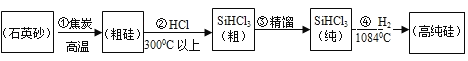
资料:SiHCl3能与H2O剧烈反应;在空气中易自燃;粗SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点﹣84.7℃)
(1)流程①中利用了焦炭的_____性。流程③中的精馏温度应不超过_____。
(2)流程④制备高纯硅的装置如图(热源及夹持装置略去):
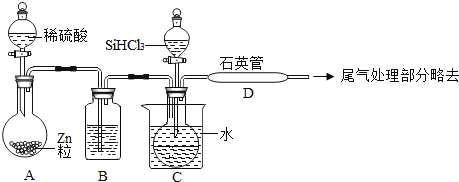
①流程④的化学反应为置换反应,写出其化学方程式:_____。
②装置B中的试剂是_____;装置C中的烧瓶需要加热,其目的是_____。
③反应一段时间后,装置D中观察到的现象是_____。
④为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_____。
(3)该流程中能够循环利用的物质是_____。
【答案】还原 33℃ SiHCl3+H2![]() Si+3HCl 浓硫酸 使进入烧瓶的液态SiHCl3变为气体 有固体物质生成 排尽装置内的空气 HCl。
Si+3HCl 浓硫酸 使进入烧瓶的液态SiHCl3变为气体 有固体物质生成 排尽装置内的空气 HCl。
【解析】
二氧化硅和碳在高温的条件下生成硅和一氧化碳,SiHCl3和氢气在高温的条件下生成硅和氯化氢,硅极易被氧化生成氧化硅。
(1)二氧化硅和碳在高温的条件下生成硅和一氧化碳,粗SiHCl3(沸点33.0℃),所以流程①中利用了焦炭的还原性,流程③中的精馏温度应不超过33℃。
(2)①SiHCl3和氢气在高温的条件下生成硅和氯化氢,化学方程式为
SiHCl3+H2![]() Si+3HCl。
Si+3HCl。
②SiHCl3能与H2O剧烈反应,在空气中易自燃,浓硫酸具有吸水性,所以装置B中的试剂是浓硫酸,装置C中的烧瓶需要加热,其目的是:使进入烧瓶的液态SiHCl3变为气体。
③SiHCl3和氢气在高温的条件下生成硅和氯化氢,所以反应一段时间后,装置D中观察到的现象是:有固体物质生成。
④硅极易被氧化,所以为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及排尽装置内的空气。
(4)既是反应物,也是生成物的物质可以循环利用,所以该流程中能够循环利用的物质是HCl。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】空气是一种重要的自然资源。
(1)某化学兴趣小组用如图所示装置测定空气中氧气的体积分数,请回答:
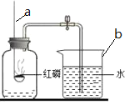
①写出仪器的名称:a______;b______。
②写出红磷燃烧的文字表达式为______,红磷燃烧时可观察到产生大量的______,该实验中红磷的量要足的原因是______。
③冷却到室温便打开止水夹可以观察水会进入集瓶中约占它剩余容积的______,由此得出该实验的结论是______。
④实验所用的红磷能不能用木炭代替________(填“能”或“不能”),装置右边烧杯中的水的作用是______。
(2)经化学家的不断实验,得出空气的组成为:按体积分数计算,氧气与氮气的体积比约为_________;稀有气体约占________%;二氧化碳约占______%;其他气体和杂质约占0.03%。
(3)随着工农业的发展,空气不断受到污染,请写出一种由空气污染所造成的环境问题______,为了保护空气,请写出防治空气污染的一种措施______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 为进一步认识氧气,老师邀请你一起参加《实践活动1氧气的实验室制取和性质》的研究。请根据下图所示装置回答问题:
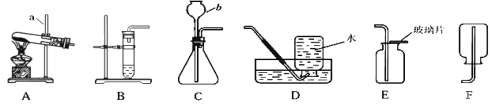
(l)写出仪器a和b的名称:a________ b________。
(2)某同学选用A装置制取氧气,在连接玻璃管和带孔橡皮塞时,玻璃管不容易插入橡皮塞,应采取的措施是:________。在试管中装入暗紫色的固体物质,则发生反应的文字表达式为 __________;该反应属于__________反应。
(3)实践证明用B装置制氧气比A装置具有很多优点,主要优点有___________。
A 安全 B 气密性好 C 节约能源 D 产生氧气多
(4)某同学选用C装置制取氧气,仪器b的下端没有伸到液面以下,其后果是________。
(5)若用D装置收集氧气,发现氧气不纯,可能原因是_____________。(答一点)
(6)用E装置收集一瓶氧气,检验是否收集满的方法是_____________。
(7)通过查阅资料得知:氨气(NH3)是一种密度比空气小且极易溶于水的气体,其水溶液称为氨水;实验室用加热氯化铵和氢氧化钙的固体混合物制取氨气。根据以上信息,实验室制取氨气时,应选择上图中的_______装置。(填字母编号)
(8)实验结束,同学们就P46的“问题与交流1.检查装置的气密性时,除了用手紧握的方法外,还可以用什么方法?”展开讨论,甲同学的方法得到一致认同:如图,连接好装置后,保持装置内温度不变,将玻璃管浸入烧杯内的水中,水进入玻璃管一段高度后,不再进入。若装置气密性良好,则进入玻璃管内的液面_____ 烧杯中液面。(填字母符号)
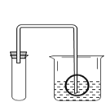
A 高于 B 低于 C 相平 D 三种情况都可以
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】已知:Na2O为白色,Na2O2为淡黄色;Na2O+H2O=2NaOH.某兴趣小组对钠和铜的单质及其化合物的性质进行了如下实验探究。
①将铜片置于铁架台的铁圈上,用酒精灯加热,观察到铜片表面变黑;
②趁热将钠置于铜片表面,钠剧烈燃烧,有淡黄色物质生成,将此淡黄色物质转移到试管中待用,再用蒸馏水冲洗铜片,观察到铜片上钠燃烧处出现了光亮的铜斑;
③向盛装淡黄色物质的试管中滴加蒸馏水,观察到冒气泡,将带火星的木条伸入试管,木条复燃。
回答下列问题:
(1)步骤①产生的黑色物质是________,步骤②淡黄色产物中氧元素的化合价为________价。
(2)步骤②中产生铜斑反应的另一产物,进一步与氧气反应也转化为淡黄色物质,则产生铜斑反应的化学方程式为________。
(3)步骤③产生的气体物质为________。
(4)猜想步骤③还可能有一种常见物质________(填化学式)生成,向反应后的溶液中滴加________溶液(可供选择的试剂:H2SO4、CuSO4、KOH、Na2CO3),观察到________的现象时,即证明了你的猜想。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学元素周期表是化学学习的重要工具,请按要求作答。
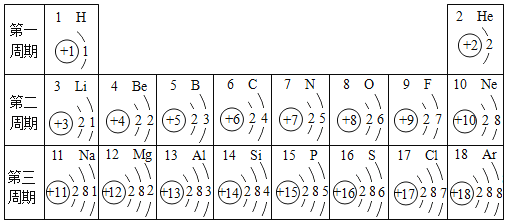
(1)元素周期表是根据_____排序的化学元素列表。元素周期表有7个周期,16个族。请写出上表中的第一主族元素名称_____。
(2)研究表明:在同一周期中,从左到右,原子失去电子的能力逐渐减弱,得到电子的能力逐渐增强,因此除稀有气体元素外,同一周期元素金属性逐渐_____(填“增强”或“减弱”下同),非金属性逐渐_____;非金属性越强,其最高价氧化物对应的含氧酸酸性越强,在①H2SiO3、②H3PO4、③H2SO4、④HClO4几种酸中,酸性由强到弱的排列顺序是_____(填序号)。
(3)第13号元素与地壳中含量最多的元素组成的物质能与NaOH溶液反应,生成偏铝酸盐(含AlO2﹣的盐),该反应的化学方程式为_____。
(4)第9号元素形成的无氧酸能与SiO2发生反应得到氟化硅气体和水,该反应的化学方程式为:_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】2017年5月,我国开采海底可燃冰获得成功。
(1)可燃冰是由甲烷分子和水分子等形成的笼状结构的固体物质,则可燃冰属于_____ (填“纯净物”或“混合物”)。
(2)1m3可燃冰可释放出约l60﹣180m3天然气。从分子性质的角度分析,其主要原因是___。
(3)图为甲烷转化为其它燃料的微观示意图。由图所示书写化学方程式_____,下列说法正确的有_____(填标号)。
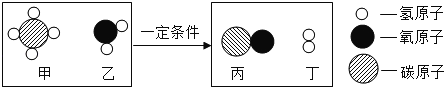
A 以上四种物质都属于化合物
B 反应物乙与生成物丙质量比为9:14
C 反应物甲与生成物丁的分子个数比为1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】工业上用电解饱和食盐水的方法制得的烧碱中常含有一定量的氯化钠。为测定某烧碱样品的纯度,同学们设计了如下方案。
方案一:称取m g烧碱样品 ![]() 测定消耗稀盐酸的质量。
测定消耗稀盐酸的质量。
方案二:称取m g烧碱样品 ![]() 测定生成沉淀的质量。
测定生成沉淀的质量。
请回答:
(1)方案一中发生反应的化学方程式为______。
(2)方案一中为减少误差,最好选择下列方法中的______。(填字母)来判断反应恰好完全进行。
A 向样品溶液中滴加2~3滴无色酚酞溶液,根据溶液颜色变化判断.
B 测定过程中边滴加稀盐酸边用PH试纸频繁测定混合液的PH
C 向样品溶液中滴加2~3滴紫色石蕊溶液,根据颜色变化判断。
(3)小李同学认为判断方案二中,氯化铁FeCl3溶液过量的化学方法是______。
(4)小李同学可将方案二中的FeCl3溶液换成稀硝酸和_______(填化学式)溶液也能达到实验的目的。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下列材料。
美丽富饶的云南被誉为“有色金属王国”,其中铝、锌、锡的保有储量居全国第一位,铜、镍的保有储量居全国第三位,是国家重要的锡、铜生产基地。
我国古代曾用“湿法炼铜”“火法炼铜”。“湿法炼铜”的原理是“曾青(硫酸铜溶液)得铁则化为铜”;“火法炼铜”中用辉铜矿(主要成分Cu2S)炼铜的原理是:Cu2S与氧气在高温条件下反应生成铜和一种会导致酸雨的气体(其相对分子质量为64)。
在河南安阳、湖北荆州、湖南宁乡、云南江川等地分别出土了后(司)母戊鼎、越王勾践剑、四羊方尊、牛虎铜案等青铜文物,充分反映出我国古代青铜器的高超熔铸技艺。青铜是铜锡合金,锡的加入明显提高了铜的强度,抗腐蚀性增强,因此锡青铜常用于制造齿轮等耐磨零部件和耐蚀配件。
虽然云南有色金属资源丰富,但是矿物的储量有限,而且不能再生,所以保护金属资源刻不容缓。
回答下列问题:
(1)下列在云南出土的文物是______(填标号)。
A 四羊方尊 B 牛虎铜案 C 越王勾践剑 D 后(司)母戊鼎
(2)可用来冶炼锡的矿石是______(填标号)。
A 菱铁矿(主要成分FeCO3) B 铝土矿(主要成分Al2O3)
C 锡石(主要成分SnO2) D 黄铜矿(主要成分CuFeS2)
(3)青铜的抗腐蚀性比纯铜的___(填“强”或“弱”)。
(4)本材料中,“湿法炼铜”的化学方程式是____,“火法炼铜”的化学方程式是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结构观、微粒观、元素观和转化观都是化学学科的基本观念。
(1)将“宏观—微观—符号”表征相结合是化学学科独特的思维方式。科学家最近在-100℃合成了一种化合物,其分子模型如下图所示。该物质的化学式是_____;从物质结构的观点说明该物质具有可燃性的原因是______,该物质在空气中完全燃烧的化学反应方程式为______。

(2)在制备物质时,根据所制物质的组成成分选择原料,要考虑原料中能否提供产品所需的成分,且能够转化到产品中。如利用海水中的NaCl制纯碱(Na2CO3)的过程中,NaCl只提供了Na2CO3所需的“Na”,则还需要能提供含有______元素的物质。按此思路,若用Na2CO3制取NaOH,需要用到生活中一种常见的廉价原料是______(填俗称)。
(3)已知由Cu到Cu(OH)2可经三步转化:Cu→CuO→CuSO4→Cu(OH)2。而Fe经两步反应得到Fe(OH)2,请补全转化的过程:Fe→______→Fe(OH)2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com