
 =3.2g,故滤渣中铁的质量为5.2g-3.2g=2g
=3.2g,故滤渣中铁的质量为5.2g-3.2g=2g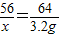 x=2.8g
x=2.8g 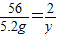 y≈0.186g
y≈0.186g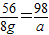 a=14g
a=14g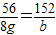 b≈21.3g
b≈21.3g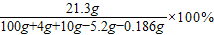 ≈19.6%,不是25%,故B错误;
≈19.6%,不是25%,故B错误;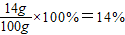 ,故ω=14,故D正确;
,故ω=14,故D正确;

科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、小于100mL | ||
| B、等于100mL | ||
| C、大于100mL | ||
D、等于
|
查看答案和解析>>
科目:初中化学 来源:不详 题型:多选题
| A.5.2g滤渣是由3.2g铜和2g铁组成 |
| B.滤液是25%的硫酸亚铁溶液 |
| C.反应过程中产生的氢气是0.286g |
| D.ω=14 |
查看答案和解析>>
科目:初中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com