
【题目】构建知识网络是一种重要的学习方法。A.B.C.D.E.F.G为常见的物质,其中B.E.G属于单质,反应②是炼铁工业中的主要反应,下图是它们之间的相互转化关系.请回答:

(1)A物质的化学式________
(2)写出反应②的化学方程式_____________;固态C物质在实际生活中的一种用途是____________
(3)写出反应③中生成红色固体的化学方程式________________
(4)写出物质G和A在加热条件下反应的化学方程式_____________________
【答案】 CuO 3CO+Fe2O3![]() 2Fe+3CO2 人工降雨 CuCl2+Fe=FeCl2+Cu CuO+H2
2Fe+3CO2 人工降雨 CuCl2+Fe=FeCl2+Cu CuO+H2![]() Cu+H2O
Cu+H2O
【解析】反应②是炼铁工业中的主要反应,B和X溶液反应生成绿色溶液F和无色气体和红色的固体,说明B是铁,F是硫酸亚铁溶液,G是氢气;E是铜;铜和氧气反应生成氧化铜,化学式为:CuO , 氧化铜和过量的盐酸反应后所得溶液是氯化铜和盐酸的混合溶液。反应②的化学方程式:3CO+Fe2O3高温2Fe+3CO2;固体二氧化碳俗称干冰,生活中常用于人工降雨。铁和氯化铜反应生成铜和氯化亚铁,反应方程式为:CuCl2+Fe=FeCl2+Cu;氢气和氧化铜在加热条件下反应的方程式为:CuO+H2![]() Cu+H2O。
Cu+H2O。


科目:初中化学 来源: 题型:
【题目】如图为氢氧化钠溶液与稀盐酸反应的微观图解,下列有关该反应的说法中错误的是( )
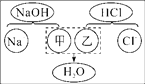
A. 粒子甲、乙分别是OH-和H+
B. 反应后的溶液中一定有Na+和Cl-
C. 反应后的溶液中Na+和Cl-的个数比一定是1∶1
D. 该反应是中和反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某小组在学习“二氧化碳与氢氧化钠溶液反应”时,进行了如下探究。
【提出问题】二氧化碳与氢氧化钠反应,还是溶解在水中?
【查阅资料】
①15℃、101kPa时,二氧化碳的溶解度如下:
溶剂 | 水 | 酒精 |
溶解度 | 1.0 | 0.5 |
②15℃时,在酒精中氢氧化钠易溶,碳酸钠微溶。
【实验设计】15℃、101kPa时,制取二氧化碳并用于实验甲、实验乙。

【分析与表达】
(1)如果二氧化碳与氢氧化钠反应,化学方程式是___________,那么氢氧化钠应____________保存。
(2)实验前,两套装置都进行气密性检查。实验甲装置气密性检查的方法是用手紧握左边的试管,若U形管内液体出现____________________现象,一段时间后回落到原位置,则说明左侧试管气密性____________(选填“良好”或“不好”);同理检查右侧试管。
(3)实验乙中,将氢氧化钠完全滴入锥形瓶中,注射器会自动向内移动并将酒精推入锥形瓶中,活塞的移动速度________(填字母)。
A.先慢后快 B.先快后慢 C.先慢后快,再变慢
实验乙中,还可能观察到的现象是___________________________________________。
(4)实验乙中,120mL酒精________(选填“能”或“不能”)换成水,原因是________。
(5)由以上探究可知,二氧化碳能溶于水,也能与氢氧化钠反应,但实验乙的数据还不够准确,造成实验乙误差的原因可能有______________________________。(写一条)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】一定质量的锌、铁分别和等量的盐酸反应,产生氢气质量与时间的关系如图所示。下列说法不正确的是( )

A. t1时,产生氢气的质量锌比铁大
B. t1时,产生氢气的速率锌比铁大
C. t2时,参加反应的锌的质量与铁相同
D. t2时,锌、铁消耗的盐酸质量相同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】白铜(Cu 、Ni合金)因为光泽好、耐腐蚀、容易加工等优点,常代替银做饰品。如图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去)。

已知溶液B中含有一种二价金属的硫酸化合物,溶液D中只有一种溶质。
分析该流程,回答下列问题:
(1)固体A的化学式为__________,过程Ⅱ中的实验操作名称是____________。
(2)过程Ⅰ中反应的化学方程式为____________________________________________。
(3)Cu、Ni、Zn的金属活动性由强到弱的顺序是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究。
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【做出猜想】a.可能与金属本身的性质有关;b.可能与盐酸的浓度有关。
【设计探究】实验所用金属均已用砂纸打磨。
【实验Ⅰ】为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡。写出锌与盐酸发生反应的化学方程式:________________________________。从实验现象可判断金属活动性:Zn________(选填“<”“=”或“>”)Fe。

【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是________________________。
【实验Ⅱ】为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是______________________________________。
所用药品、实验数据如表:
实 验 编 号 | 选用 金属 (均取 2g) | 盐酸质 量分数 (均取 50mL) | ||||||
产生氢气的体积/mL | ||||||||
第 1 min | 第 2 min | 第 3 min | 第 4 min | 第 5 min | 前5分钟 共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是________________________________________________________________________。
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸反应最后变慢的原因:________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com