
【题目】继黄金、白金之后,钯金(Pd)首饰在市场上悄然兴起。为了获得钯金,取17.7%的PdCl2溶液100g,加入10.0g铁粉使其充分反应得钯金和铁的氯化物。经分析所得钯金的质量为10.6g,未反应的铁粉质量为4.4g,下列说法正确的是( )
A. 生成铁的氯化物质量为![]() B. 生成铁的氯化物质量为
B. 生成铁的氯化物质量为![]()
C. 该反应说明钯金比铁活泼D. 生成铁的氯化物为![]()
科目:初中化学 来源: 题型:
【题目】下列实验操作、现象和结论对应正确的是( )
实验操作 | 现象 | 结论 | |
A | 向久置于空气中的NaOH溶液滴加稀H2SO4 | 有气泡产生 | NaOH和H2SO4发生了化学反应 |
B | 向某溶液中滴加BaCl2溶液 | 有白色沉淀 | 原溶液含有SO42﹣ |
C | 向集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪, 溶液变红 | CO2能与石蕊反应 |
D | 将质量相同的Mg、Zn分别投入到足量的稀HCl中 | 镁条表面产生气体更多、更快 | 金属活动性:Mg>Zn |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为了探究分子是否运动,张亮设计了如图1所示的实验。
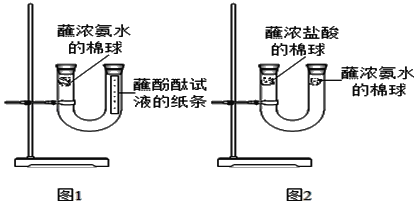
(1)一段时间后,可见图1中酚酞的液点由下往上依次变红色,他得出了结论_____,但陈红觉得张亮的实验还不足以证明,她又补充了实验,你觉得没有必要的是_____(填序号)。
A 用酒精灯对U型管加热
B 向少量浓氨水中滴加酚酞试液
C 取少量浓氨水放在空气中看是否变色
D 在U型管外放一条相同的酚酞试液纸条
酚酞变色,而棉球没有变色,说明浓氨水和酚酞两种物质中_____具有挥发性。
(2)陈红还想探究分子运动速率与哪些因素有关,她说:“我们已经知道:温度越高,分子运动速率越_____,但“可能还与相对分子质量的大小有关”画线部分的话语属于陈红在_____(填序号)。
A 设计实验 B 提出假设 C 描述现象 D 分析结论
她查找了资料:浓盐酸易挥发出HCl,浓氨水易挥发出NH3.HCl和NH3会反应产生白烟(白烟成分为NH4Cl),然后按图2所示固定装置,在U型管管口分别塞上脱脂棉,各滴加一定量浓盐酸、浓氨水,用橡皮塞塞紧,几分钟后,观察到U型管_____(“左侧”、“中间”或“右侧”)出现较多白烟,说明相对分子质量越小,分子运动速率越快。
(3)生成的白烟NH4Cl可以作为一种氮肥,质量为多少千克的NH4NO3中氮元素质量与10.7千克的NH4Cl中氮元素质量是相等的?_____(请写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为粗略测定某石灰石中碳酸钙的含量进行如下实验。(装置气密性良好,杂质不参与反应)
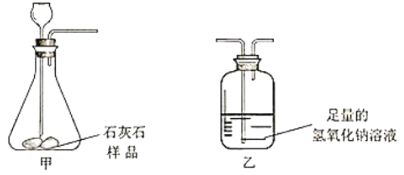
步骤I:称量装置甲和盛放的石灰石样品的总质量;装置乙和盛放的氢氧化钠溶液的总质量。步骤II:连接装置甲和乙,盐酸由长颈漏斗加入到锥形瓶中至气泡不再产生为止。
步骤III:二氧化碳被完全吸收后,测得装置甲及其盛放的药品增重了37.8克;装置乙及其盛放的药品增重了2.2克。
(1)盐酸中的溶质是______(填写名称)。
(2)二氧化碳与氢氧化钠溶液反应的化学方程式是______。装置乙吸收的二氧化碳为______摩尔。
(3)该石灰石样品中碳酸钙物质的量_____。(根据化学方程式列式计算)
(4)实验中所加的盐酸溶质质量分数可能为______(选填编号)。
a 5% b 7% c 10%
(5)如所用的盐酸溶质质量分数过大,对碳酸钙含量测定结果的影响是______(选填“偏大”“偏小”或“无”),理由是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取某些气体所需的装置如图所示,请回答下列问题:
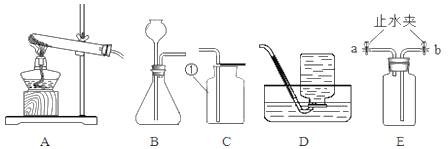
(1)实验仪器①的名称是______
(2)实验室制取二氧化碳气体应选择的发生装置是______(填选项字母)。该同学想要用E装置除去CO2中的氯化氢杂质,则该装置中盛放的物质是______;写出该装置中有关反应的化学方程式:______。
(3)选择收集气体方法时,必须考虑的气体性质有______(填序号)。
①颜色②密度③溶解性④可燃性
(4)若用装置E排水收集氧气,瓶内先装满水,气体从______(填“a”或“b”)导管通入瓶内。
(5)若选A装置作为用高锰酸钾制取氧气的发生装置,还须补充的一种用品是______,反应的化学方程式为______
查看答案和解析>>
科目:初中化学 来源: 题型:
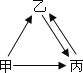
【题目】甲、乙、丙三种物质均含地壳中含量最多的元素.甲、乙是组成元素完全相同 的化合物,丙是单质;乙通常为液体,在一定条件下可分解生成丙;它们之间有如右图所示的转化关系(部分物质和反应条件已经略去).则:
甲的化学式为 ;乙分解生成丙的化学方程式为 .
从微观的角度解释甲、乙性质有差异的原因是 .
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组在老师的指导下进行课外实验,利用下列装置来探究磷单质在空气中燃烧后氧气浓度的变化情况。
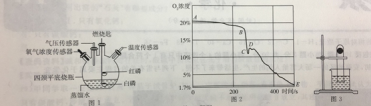
(提出问题)足量红磷在密闭的四颈平底烧瓶内充分燃烧,熄灭后,容器中是否有氧气剩余?
(猜想假设)猜想①:有氧气剩余;
猜想②:无氧气剩余。
(实验验证)该小组同学按如图1组装好实验装置,用高能激光笔分别照射燃烧匙上的红磷和白磷,红磷燃烧直至熄灭,白磷无明显变化;待装置完全冷却后,将装有白磷的燃烧匙提出水面,再次用高能激光笔照射,白磷被点燃。
(1)激光笔的作用是________________________。
(2)红磷的燃烧产物与瓶底热水反应生成磷酸(H3PO4)的化学方程式_________________ 。
(3)实验过程中燃烧匙内的白磷第一次未燃着的原因是_________________ 。
(实验结论)根据上述实验现象,得出如下结论
(4)结论1:猜想_______正确
结论2:课本上“燃烧红磷测定空气中氧气含量”的方法是_____(选填“严谨”或“不严谨”)的,其理由是_________________ 。
(注意:若答对第(5)(6)小题奖励4分,化学试卷总分不超过60分。)
(拓展延伸)如图2是该小组同学从开始实验到最后装置冷却后的整个实验过程中,用氧气传感器测量容器内氧气浓度变化的曲线图
(5)在图中_____ (选填“A”“B”“C”“D”或“E")点时红磷燃烧熄灭。请你解释曲线AB段、DE段氧气浓度变化的主要原因
①________________________。
②________________________。
(6)小组同学通过查阅资料得知,能够较精确地验证空气中氧气体积分数的药品是铁丝绒,利用铁与氧气、水等的缓慢氧化,可以将空气中的氧气浓度消耗至0.2%。将足量细铁丝绒固定于试管底部,并倒扣在装有水的烧杯中(如图3),一段时间后你将看到的现象是________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】常温下,向一定量的碳酸钠溶液中不断加入氢氧化钡粉末,溶液质量的变化情况如图所示。对该图的分析有如下几种说法,正确的是
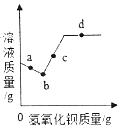
A. 向a点溶液中滴加无色酚酞溶液,溶液变红,可证明有氢氧化钠生成
B. 取少量b点溶液,滴入过量稀盐酸,有气泡产生
C. c点溶液中的溶质只有氢氧化钠
D. 该温度下,向d点溶液中加入氢氧化钡粉末,溶质质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学兴趣小组做了如图所示实验,当向乙烧杯中依次加入MnO2和H2O2溶液时,发现有大量气泡产生,并产生大量白雾,蜡烛燃烧更旺,但过一会儿逐渐熄灭。而甲烧杯中蜡烛一直持续燃烧。
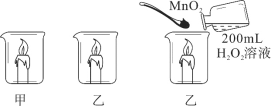
(知识回忆)写出过氧化氢分解产生氧气的化学方程式:_____。
(问题1)导致乙烧杯中蜡烛熄灭的原因是什么?
(作出猜想)猜想一:燃烧产生的CO2使蜡烛熄灭;
猜想二:白雾是水雾导致蜡烛熄灭;
小组同学经过讨论,排除了猜想一,其理由是_____。
(实验1)向一只装有燃者蜡烛的烧杯中加入100℃水,另一只依次加入MnO2和H2O2溶液,若观察到_____的现象,则猜想二正确。
(查阅资料)水雾产生与H2O2溶液的溶质质量分数大小有关,并且H2O2溶液的溶质质量分数越大,产生的水雾越多。
(问题2)为什么H2O2溶液的溶质质量分数越大水雾越多呢?
(实验2)分别向三只烧杯依次加入MnO2和溶质质量分数的不同H2O2溶液测定温度变化。
H2O溶液 | 5% | 10% | 30% |
温度变化曲线 |
|
|
|
(解释与结论)
(1)该对比实验过程中不需要控制的条件是_____。
A H2O2溶液的初始温度相同 B 反应开始的时间相同 C 二氧化锰的质量相同
(2)根据实验2,可得出的一个结论是_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com