
【题目】某实验室用含硫酸铜和盐酸的混合液与混入了锌粉的铜粉(以下简称铜锌粉)反应来测定混合液中盐酸的质量分数和铜锌粉中锌的含量。操作如下:取200 g混合液于实验容器中,分五次加入铜锌粉,边加边搅拌,以保证盐酸和硫酸铜同时与锌充分反应。实验测得的相关数据如下表:
第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
加入铜锌粉的累计质量/ g | 9 | 18 | 27 | 36 | 40 |
产生氢气的累计质量/ g | 0.1 | 0.2 | m | 0.4 | 0.4 |
容器中剩余固体的质量/ g | 5.71 | 11.42 | 17.13 | 22.84 | 26.84 |
(1)表中m的值为_____________。
(2)第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为_____________。
(3)计算原混合液中盐酸的质量分数是多少_____________?(写出计算过程,结果精确到0.1%)
(4)通过计算可知,每9 g铜锌粉中含有_______________g锌粉。
【答案】 0.3 ZnSO4 、ZnCl2 7.3% 5.85
【解析】(1)根据表中数据分析解答;(2)对比第四次、第五次加入铜锌粉分析解答;(3)根据反应的化学方程式计算解答;(4)根据计算解答。(1)对比第一次、第二次可知,每加入9g铜锌粉可产生0.1g氢气,第四次加入铜锌粉后产生了0.4g氢气,m为第三次加入铜锌粉后产生氢气的质量。故m值为0.3;(2)对比第四次、第五次加入铜锌粉后产生氢气的质量不再增加,说明第四次加入铜锌粉后盐酸与锌粉恰好完全反应,故第四次加入铜锌粉并充分反应后,溶液中所含溶质的化学式为ZnSO4 、ZnCl2;(3)设产生0.4g氢气消耗盐酸的质量为x,消耗锌的质量为y。
Zn+2HCl=ZnCl2+H2↑
65 73 2
y x 0.4g
![]()
x=14.6g
y=13g
原混合液中盐酸的质量分数为![]() ×100%=7.3%
×100%=7.3%
(4)生成0.1g氢气时需要锌的质量为13g÷4=3.25g
设反应生成铜的质量为A。
生成0.1g氢气时与硫酸铜反应的锌的质量为9-3.25g-(5.71g-A)=0.04g+A
Zn+CuSO4=Cu+ZnSO4
65 64
0.04g+A A
![]()
A=2.56g
9 g铜锌粉中含有锌粉的质量=2.56g+0.04g+3.25g=5.85g
答:(3)原混合液中盐酸的质量分数是7.3%;(4)每9 g铜锌粉中含有5.85g锌粉。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图装置制取并收集一瓶二氧化碳气体,请和他们一起完成以下实验探究。
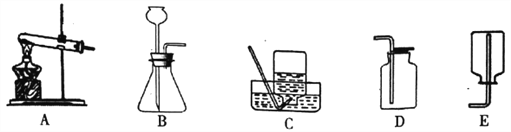
(1)实验室制取一瓶二氧化碳气体,应选用的发生装置为______________(填序号),反应的化学方程式为___________________。
(2)一氧化氮是一种密度比空气略大,难溶于水的无色气体,易与空气中的氧气反应生成红棕色的二氧化氮气体,则收集一氧化氮气体应选择________装置。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学实验室制取气体的部分仪器或装置如图所示,请回答下列问题。
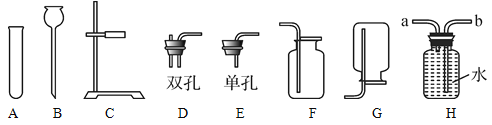
(1)仪器C的名称:________。
(2)若用锌粒与稀硫酸反应制取氢气,发生装置中已经选择了A、C、D,则还要选择以上仪器中的________(写名称);若用装置H收集氢气,氢气应从________(填“a”或“b”)端通入。
(3)某同学用上述(2)中的方法制取氢气,结果未收集到氢气,请你帮他分析可能的原因是_____________。(写一条即可)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图为甲、乙两种固体物质(不考虑结晶水) 的溶解度曲线。下列说法错误的是( )
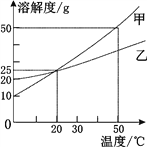
A. 20 ℃时,甲、乙具有相同的溶解度
B. 甲、乙的溶解度都随温度的升高而增大
C. 20 ℃时,可以配制溶质的质量分数为25%的甲溶液
D. 50℃时,甲和乙各30g分别加入100g水中,充分溶解后同时等速降温,则乙溶液先成为饱和溶液。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在如图所示的转盘中,A~F分别代表Na2CO3、NaNO3、NaOH、HNO3、Na2SO4、NaCl六种物质中的一种。已知:B的俗名为纯碱,A和E可发生中和反应,A、B、C、D、E都能转化成F,A、B、C、D能依次转化。请根据初中所学化学知识回答下列问题:
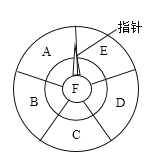
(1)F的化学式为__________________。
(2)让指针逆时针从当前位置开始转动,若所指物质能转化为下一物质,指针可继续转动,否则停止。则使指针停止转动的物质D为________(填物质名称)。
(3)让指针顺时针从当前位置开始转动,若所指物质不能转化为下一物质,指针可继续转动,否则停止。则指针将停止在_________(填字母编号)物质上。
(4)写出下列指定的化学方程式:
①E转化成F的中和反应________________________________;
②C转化成D__________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学促进人类社会发展。
⑴ 可用Mg、Al等和稀硫酸反应制取氢气,反应类型属于__________反应;也可用Mg、Al和NaOH溶液组成化学电池,它可以将化学能转化为_________能。
⑵ Mg17Al12是一种新型储氢材料,一定条件下完全吸氢后转化为MgH2和Al,反应方程式为_____。
⑶ 科学家认为“氢能将成为未来的理想能源”,原因是(___________)
A.完全燃烧放出热量多 B.制取原料资源不受限制
C.燃烧产物不污染环境 D.目前制取效率高成本低
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为探究物质的燃烧条件,某同学进行了如下图所示的实验。下列说法正确的是
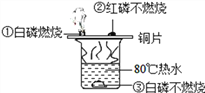
A. 现象①③说明物质燃烧需要达到一定的温度
B. 现象②说明红磷不是可燃物
C. 现象①②说明白磷的着火点比红磷低
D. 现象③说明白磷的着火点高于80℃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组的甲、乙两同学围绕Na2CO3进行了如图一所示的实验。实验结束后,丙同学把A、B两支试管中的物质倒入同一洁净的烧杯中(如图二),充分混合后发现白色沉淀明显增加。
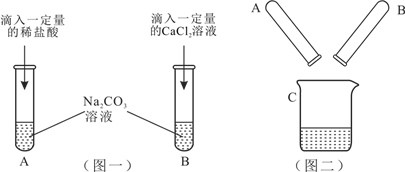
(1)往试管内滴加液体所用的仪器是_____(填仪器名称);正确操作是__________________。甲同学的实验完成后,A试管一定有剩余的物质是___________________________。
小组同学将C中液体过滤后,对所得滤液的主要成分进行了如下探究:
【猜想与假设】实验小组的同学对滤液的成分作出了如下猜想:
猜想一:滤液中的溶质是NaCl Na2CO3
猜想二:滤液中的溶质是NaCl、CaCl2
猜想三:滤液中的溶质是NaCl、CaCl2、HCl
猜想四:滤液中的溶质是NaCl
【讨论与交流】通过认真讨论,小组同学排除了其中一种不合理的猜想。
(2)你认为不合理的猜想是______,理由是_________________(用化学方程式说明)
【进行实验】丁同学取少量滤液置于试管中,向试管中滴加一种物质,发现有无色气泡生成。
(3)你认为丁同学向滤液中滴加的物质是_________________________。
【实验结论】通过探究,小组同学得出了猜想一是正确的的结论。
【实验反思】(4)分析实验后所得溶液中溶质成分时,除生成物外,还要考虑_______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】铝跟盐酸或氢氧化钠溶液都能反应且产生H2。反应的化学方程式如下:2Al + 6HCl = 2AlCl3 + 3H2↑;2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。甲、乙两烧杯中各盛有109.5g 10%的盐酸和120g 10%NaOH溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体质量比为甲∶乙=1∶2,则加入铝粉的质量为
A. 1.8g B. 2.7g C. 3.6g D. 5.4g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com