
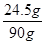 ×100%=27.2%
×100%=27.2%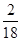 ):(7×
):(7×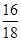 +3×
+3×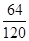 )=35:352。
)=35:352。

科目:初中化学 来源:不详 题型:单选题
| A.只含有碳、氢两种元素 | B.含碳、氢、氧三种元素 |
| C.含有碳、氢两种元素,可能含有氧元素 | D.无法确定 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
 Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )
Na2CO3+H2O+CO2↑.现取NaHCO316.8g,在敞口容器中加热到质量不再改变为止,减少的质量为( )| A.4.4g | B.6.2g | C.8.8g | D.10.6g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.向左、右两烧杯中分别加入5.6 g Fe和1.8 g Al,两种金属完全溶解 |
| B.向左、右两烧杯中分别加入相等质量的Al、Zn,两种金属完全溶解 |
| C.向左、右两烧杯中分别加入相等质量的Fe、CaCO3,反应后盐酸均有剩余 |
| D.向左、右两烧杯中分别加入相等质量的Mg、Al,反应后两种金属均有剩余 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题

查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:初中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com