
分析 依据铁能和硫酸铜溶液反应生成铜和硫酸亚铁进行书写即可;
【方案设计】(1)运用氧气支持燃烧能使带火星的木条复燃解答.
(3)根据硫酸铜溶液的成分分析.
【实验探究】运用氢气的燃烧现象分析判断
【思维拓展】
运用金属和酸的反应能生成氢气的特点进行解答.
解答 解:铁能和硫酸铜溶液反应生成铜和硫酸亚铁,其方程式为:Fe+CuSO4=FeSO4+Cu;
【方案设计】
(1)氧气的鉴定一般是:用带火星的木条伸入收集的气体中,若复燃,说明是氧气;
(3)硫酸铜溶液中含有水,其中含有氢元素,该气体可能是氢元素组成的氢气;
【实验探究】根据实验的现象:气体在空气里安静的燃烧,产生淡蓝色火焰,烧杯壁上有水珠生成,接触烧杯的手能感觉到发热.说明这种气体是氢气;氢气燃烧生成水,反应的化学方程式为:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O.
【思维拓展】因为活动性在氢前的金属和酸反应能产生氢气,所以由上述实验可以推出,可断定该溶液呈酸性;
故答案为:Fe+CuSO4=FeSO4+Cu;
【方案设计】
(1)用带火星的木条伸入收集的气体中,若复燃,说明是氧气;
(2)氢气;
【实验探究】2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O;
【思维拓展】酸性.
点评 本题综合考查了金属的化学性质、氧气的检验、使用氢气的注意事项以及碱的部分性质,解题的关键是进行知识的迁移和灵活运用.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
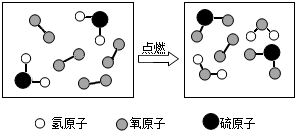
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 单质 | 氧化物 | 氢化物 | 酸 | 碱 | 盐 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

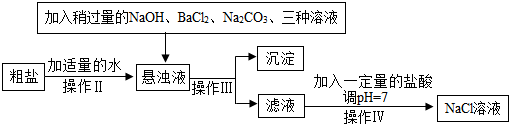
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
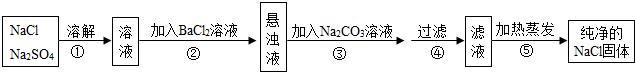
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com