
【题目】甲、乙两种固体物质的溶解度曲线如图所示。下列有关叙述中错误的是
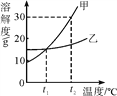
A. t1 ℃时,甲物质的溶解度与乙物质的溶解度相等
B. t2 ℃时,将20 g甲物质放入50 g水中,所得溶液为饱和溶液
C. 升高温度可将甲物质的饱和溶液变为不饱和溶液
D. 当甲物质中含少量乙物质时,可用蒸发溶剂的方法提纯甲物质
【答案】D
【解析】由图中信息知,A、t1 ℃时,甲物质的溶解度与乙物质的溶解度相等,两曲线相交,溶解度相等,故A正确;B、t2 ℃时,甲物质溶解度是30个,将20 g甲物质放入50 g水中,最多溶解15g,所得溶液为饱和溶液,故B正确;C、甲物质溶解度随温度升高而增大,升高温度可将甲物质的饱和溶液变为不饱和溶液,故C正确;D、甲物质溶解度受温度影响较大,乙物质溶解度受温度影响变化不大,当甲物质中含少量乙物质时,可用蒸发结晶的方法提纯甲物质,故D错误。
点睛∶溶解度曲线的意义⑴表示同一种物质在不同温度时的溶解度或溶解度随温度变化的情况;⑵表示不同物质在同一温度时的溶解度,可以比较同一温度时,不同物质的溶解度的大小。若两种物质的溶解度曲线相交,则在该温度下两种物质的溶解度相等;⑶根据溶解度曲线可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;⑷根据溶解度曲线能进行有关的计算。


科目:初中化学 来源: 题型:
【题目】用100 g KClO3和MnO2的混合物,测得MnO2 占混合物总质量的25%。
求:(1)混合物中氧元素的质量分数是多少(计算过程中保留两位小数)。
(2)如果给混合物加热使其发生反应,一段时间后,测得剩余物质含有KClO3、MnO2和KCl,其剩余物质的总质量为95克。求此剩余物质中Mn元素的质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】阅读下面科普短文。
在中国古代化工发展的历史征程中,我国古代先民们在火药、制陶烧瓷、炼铜冶铁等化学加工技术方面取得了许多非凡的成就,为促进我国古代社会发展和人类的进步做出了重大的贡献。
【火药】人类最早使用的火药是黑火药,主要反应如下:

【制陶烧瓷】瓷器与陶器,都属于硅酸盐系列制品,最主要的化学成分是二氧化硅(SiO2)、氧化铝(Al2O3)及多种金属(Ca、Mg、Fe、K、Na等)氧化物。但在化学成分含量、用途等方面却大有区别。
制品 | 化学成分 | 性能用途等 |
陶器 | Al2O3 约15%~18%; Fe2O3约5%~6%; CaO、MgO等≥3%。 | 粗糙,不够坚硬,常用于取水、盛放食物等。 |
瓷器 | Al2O3 约18%~28%; Fe2O3约1%~2%; CaO、MgO等≤1%。 | 高温烧结,坚硬致密,洁白,薄, 呈半透明,敲击时清脆悦耳,美观,用途广泛,观赏、收藏价值高等。 |
【金属冶炼】制陶发展起来的高温技术为金属的冶炼、熔铸创造了条件,我国由新石器时代晚期逐步进入了先是炼铜(称为“青铜器时代”)后是炼铁(称为“铁器时代”)的金属时代。
青铜冶炼
天然铜夹杂在铜矿石之中,人们在加热熔化天然铜的过程中,将绿色的孔雀石[Cu2(OH)2CO3]、棕或黑色的锡石(SnO2)、蓝色的方铅矿(PbS)放在一起烧,便产生了青铜。青铜是铜与锡或铅熔成的合金。熔点比纯铜(1083℃)低100℃~300℃,更易加工和铸造,铸造性能也比纯铜好,硬度几乎提高一倍,适合制作工具和兵器。
铁的冶炼
到了春秋中后期,我国先民们在熟悉地掌握了块炼法炼铁后,又在世界上率先发明了以高温液体还原法冶炼生铁的技术,这在冶金史上是一个划时代的进步。
随着炼铁技术的进步,人们也逐渐懂得了炼钢。生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。依据文章内容回答下列问题。
(1)黑火药的主要成分是________。
(2)陶器与瓷器化学成分的主要区别是_________。
(3)生铁的碳含量______(填“高于”或“低于”)钢的碳含量。
(4)与纯金属相比,合金的优点可能是________。
【答案】 硝酸钾、木炭、硫(KNO3 、C、S) 陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高 高于 硬度大、熔点低
【解析】本题考查了根据短文黑火药、陶器与瓷器化学成分,铁合金的成分和性质,认真阅读短文是解题的关键。
(1)从题中提供的化学方程式可知,黑火药的主要成分是硝酸钾、木炭、硫(KNO3 、C、S);
(2)根据陶器与瓷器化学成分表可知,陶器与瓷器化学成分的主要区别是:陶瓷中Al2O3含量比瓷器低,Fe2O3、CaO、MgO含量比瓷器高;
(3)生铁和钢都是铁碳合金。含碳量>2%,为生铁;含碳量<0.02%,为纯铁;含碳量在两者之间为钢。生铁的碳含量高于钢的碳含量;
(4)与纯金属相比,合金的优点可能是:硬度大、熔点低。
【题型】简答题
【结束】
21
【题目】工业上制取硝酸铵(NH4NO3)的流程图如下,请回答下列问题。
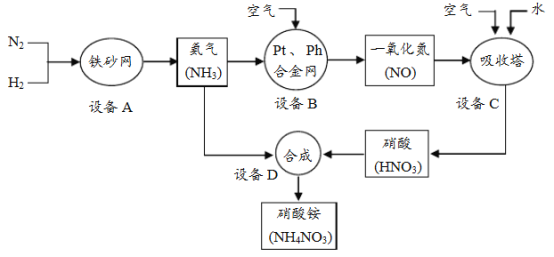
(1)设备A中,发生的反应属于基本反应类型中的________。
(2)设备B、C中,空气中的______一定参加了反应。
(3)设备C中,生产硝酸过程排出的废气中会含有一些氮的氧化物,可用如下两种
方法处理:
方法一、NaOH溶液吸收法:NO + NO2 + 2NaOH = 2NaNO2 + H2O
方法二、NH3还原法:8NH3 + 6NO2![]() 7N2 + 12H2O(NO也有类似的反应)
7N2 + 12H2O(NO也有类似的反应)
以上两种方法中,你认为哪种方法好并说明理由________。
(4)设备D中,用NH3和HNO3制备NH4NO3。NH4NO3中氮元素质量分数的计算式为________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天然气的主要成分是甲烷(CH4),对甲烷燃烧的产物进行实验探究:
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO。
【对燃烧产物的猜想与假设】甲:CO2、H2O;乙:CO、H2O;丙:NH3、CO2、H2O;丁:CO2、CO、H2O。
你认为__________的猜想是错误的,理由是____________________________;
【实验探究】为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
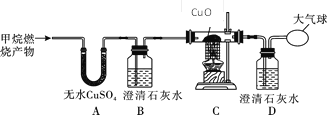
①A、B装置的顺序能否颠倒?(填“能”或“否”)________________;
②实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中黑色粉末变成红色,由此推断_________________同学的猜想成立;
③请写出A、B、C装置中发生反应的化学方程式:A._______________、B.__________________、C._________________;
【反思与交流】为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氢能是理想的清洁能源。以太阳能为热源,经由铁氧化合物循环分解水的过程如下:
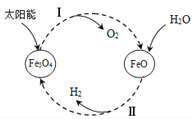
(1)反应Ⅰ的基本反应类型为_____________。
(2)写出在一定条件下发生的反应Ⅱ的化学方程式_______________。
(3)在上述循环过程中,最终得到的产品是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图提供的几种物质的溶解度曲线,判断下列说法正确的是

A. 氯酸钾中混有少量氯化钠,提纯氯酸钾最好用蒸发结晶的方法
B. 30 ℃时氯酸钾饱和溶液的溶质质量分数为10%
C. 80 ℃时7 g NaCl和20 g水能形成饱和溶液
D. 控制温度,图中氯酸钠和氯化钾能发生化学反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列化学方程式书写正确的是
A. NaOH+CuSO4=Cu(OH)2↓+NaSO4 B. 2Mg+O2![]() 2MgO
2MgO
C. 2KMnO4=K2MnO4+MnO2+O2 D. C+O2=2CO2↑
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】天冷了,很多同学都用上了“暖宝宝”。某实验小组查阅其原料主要成分为: 铁粉、活性炭、食盐。“暖宝宝”发热的原因是铁粉发生氧化反应而生成铁锈,并且放出热量(其主要反应的化学方程式为:4Fe+3O2=Fe+3O)在实验小组取“暖宝宝”中的物质样品共20g,待其完全反应后称得质量为24.8g,
请计算∶
(1)Fe2O3中铁、氧元素的质量比是多少?
(2)参加反应的氧气质量是多少?
(3)样品中铁粉的质量分数是多少?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学利用石灰石和稀盐酸进行如下实验,操作过程和数据如图(样品中杂质不与酸反应也不溶于水)。
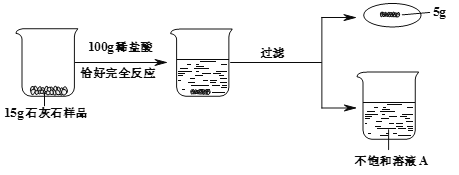
(1)15g石灰石样品中CaCO3物质的量。
(2)列式计算不饱和溶液A的溶质质量分数(结果准确到0.1%)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com