
【题目】实验室现有石灰石、高锰酸钾、稀盐酸等药品及相关仪器和用品,请结合下列装置回答问题:
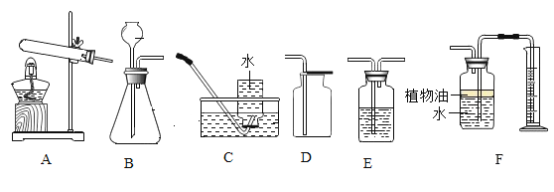
(1)利用现有仪器和药品制取氧气,还需要补充的一种用品为_________,补充此用品后便可以制取氧气了,发生反应的化学方程式为__________________________。从水槽中取出盛满氧气的集气瓶________(选填“正”或“倒”)放在实验台上。
(2)欲制取二氧化碳气体,需要选择的发生装置是_________(填字母),一般用 D 装置收集二氧化碳,如果 E、D 相连共同使用,可收集到干燥的二氧化碳,则 E 装置内应盛有的液体是_______。也可以用 F 装置收集二氧化碳,随着反应的进行,装置内气体量不断增多,__________,大于外界大气压,在压强差的作用下,水被排出,瓶内收集到二氧化碳。若 F 装置内不含有植物油,则收集的二氧化碳气体的体积比真实制得气体的体积_______(选填“大”或“小”)。用量筒盛接水的目的是:通过盛接的量筒内水的体积,可以测得_________________________。
【答案】棉花 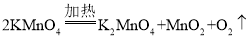 正 B 浓硫酸 压强增大 小 生成二氧化碳的体积
正 B 浓硫酸 压强增大 小 生成二氧化碳的体积
【解析】
(1)利用现有仪器和药品制取氧气,可用加热高锰酸钾的方法,需要在试管口塞一团棉花,还需要补充的一种用品为棉花,补充此用品后便可以制取氧气了,加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,发生反应的化学方程式为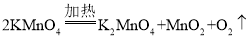 。氧气密度比空气大,从水槽中取出盛满氧气的集气瓶正放在实验台上。
。氧气密度比空气大,从水槽中取出盛满氧气的集气瓶正放在实验台上。
(2)欲制取二氧化碳气体,使用石灰石与稀盐酸反应,属于固液混合不需加热型,需要选择的发生装置是B,一般用 D 装置收集二氧化碳,如果 E、D 相连共同使用,可收集到干燥的二氧化碳,则 E 装置内应盛有的液体是浓硫酸,浓硫酸具有干燥作用。也可以用 F 装置收集二氧化碳,随着反应的进行,装置内气体量不断增多,压强增大,大于外界大气压,在压强差的作用下,水被排出,瓶内收集到二氧化碳。若 F 装置内不含有植物油,则收集的二氧化碳气体的体积比真实制得气体的体积小,因为二氧化碳溶于水并与水反应。用量筒盛接水的目的是:通过盛接的量筒内水的体积,可以测得生成二氧化碳的体积。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】Ⅰ、下列有关实验操作的描述正确的是______。
A测稀硫酸的pH时,用玻璃棒蘸取溶液滴到湿润的pH试纸上,把试纸显示的颜色与标准比色卡对照
B用CO还原氧化铜时,应先通入CO,后用酒精灯给硬质玻璃管加热
C称量氢氧化钠固体时,应将氢氧化钠固体放在小烧杯中然后放在天平的右盘上称量
D配制50g质量分数为6%的NaCl溶液,在量取液体体积时俯视读数
E蒸发氯化钠溶液结晶时,要把溶液蒸干后再停止加热
II、水是一种重要的资源,爱护水资源,人人有责。用如图所示装置进行电解水的实验
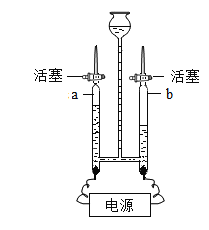
(1)该实验中a、b两玻璃管中收集到的气体质量比为_____,
(2)该实验证明水是由_______组成的;
(3)饮用硬度过大的水不利于人体键康,在生活中可用_________区分硬水和软水。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】元素的化学性质与其原子结构有着密切关系
(1)已知钙原子的结构示意图为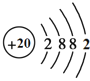 ,则钙元素位于第_______周期。
,则钙元素位于第_______周期。
(2)钙原子和镁原子的化学性质相似,其原因是________
(3)已知偏硅酸的化学式为H2SiO3,则偏硅酸钙的化学式为______________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题。
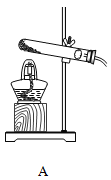
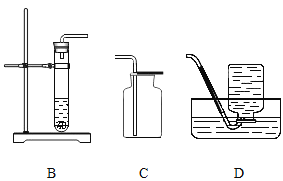
(1)写出一个实验室制氧气的化学方程式,并选择制取装置。
① 化学方程式:_______。② 制取装置: _______
(2)实验室收集二氧化碳用装置 C 而最好不用装置 D 的原因是_________, 实验室制取二氧化碳的方程式为_______
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小冰取一定量某浓度的氢氧化钡溶液,向其中加入 14.2g 硫酸钠,充分反应后过滤,得到滤液 190.9g。向滤液中加入 200g 质量分数为 7.3%的稀盐酸,恰好完全反应,得到中性溶液。则原氢氧化钡溶液中溶质的质量分数为( )
A.34.2%B.25.65%C.17.1%D.8.55%
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列应用的原理(用化学方程式表示)及基本反应类型均正确的是( )
A. 用赤铁矿高炉炼铁:Fe2O3+3CO![]() 2Fe+ 3CO2 置换反应
2Fe+ 3CO2 置换反应
B. 用NaOH检测溶液中的FeCl3:3NaOH+ FeCl3== Fe(OH)3↓+3NaCl 复分解反应
C. 加热混有二氧化锰的氯酸钾制取氧气2KClO3![]() 2KCl+3O2↑ 化合反应
2KCl+3O2↑ 化合反应
D. 用木炭测定空气中氧气含量:C+O2![]() CO2 分解反应
CO2 分解反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是实验室制备气体的部分装置。
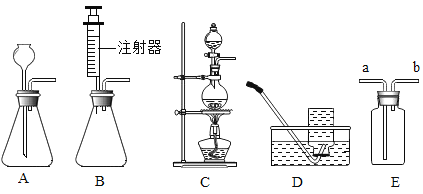
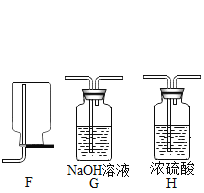
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
①H2O2溶液和MnO2固体,常温 | _____ | A或B | _____或E |
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | _____ | E |
③甲酸(HCOOH)和浓硫酸,加热 | CO | _____ | D |
(2)用A装置制取O2时,反应的化学方程式为_____,若要得到干燥的O2,所选择装置的连接顺序为:A→_____→E(填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)_____端进入。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国化工专家侯德榜发明了侯氏制碱法,为世界制碱工业作出了突出贡献。
(1)主产品Na2CO3的俗名是_____,副产品氯化铵中阳离子符号为_____。
(2)在实际生产中,产品Na2CO3中常混有少量的NaCl,现有样品11.0 g,将其放入干净的烧杯中,向烧杯中滴加入溶质质量分数为7.3%的稀盐酸,反应后烧杯中物质的质量与滴入稀盐酸的质量关系如图所示。
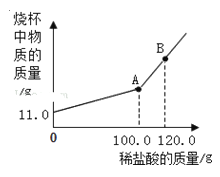
①图中A点表示_____,B点的溶质为_____。
②计算样品中Na2CO3的质量分数(计算结果精确至0.1%)_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1)。
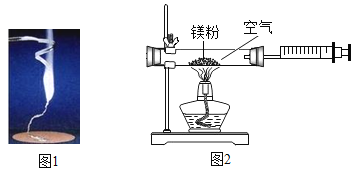
(1)请写出镁条与氧气反应的化学方程式_________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是______________。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[查阅资料]①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
[提出问题]黄色固体是什么呢?
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
如图,取燃烧产物中的黄色固体于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:____________。 结论:燃烧产物中含Mg3N2 |
[反思与交流]
空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,请给出合理的解释______________。
[拓展延伸]
①根据题意,2.40g 镁条在空气中完全燃烧,所得固体质量为m,则m的取值范围____________。
②反思实验探究过程,谈谈你对物质燃烧条件的新认识__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com