A.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO
2的废气和含H
2SO
4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.只要下雨就下酸雨,对该镇环境造成极大破坏.
(1)分析该镇下酸雨的原因:
;
(2)举一例说明酸雨对环境造成的危害:
;
(3)二氧化硫是大气污染物,溶于水所得溶液的pH
7(填“大于”、“小于”或“等于”);二氧化硫气体可用氢氧化钠溶液来吸收,请写出该反应的化学方程式:
;
(4)该镇某中学环保小组提出了治理酸雨的下列措施,你认为其中不妥的是
A.将硫酸厂搬离该镇
B.建议环保部门下令整改
C.将硫酸厂排出的废气中的SO
2处理后排放
D.工厂和居民改用较清洁的燃料
(5)可用熟石灰来处理硫酸厂排出的酸性废水,处理原理的化学方程式是
;
(6)浓硫酸弄到手上后应立即用水冲洗,然后涂上碳酸氢钠.若是稀硫酸弄到手上,
(填“需要”或“不需要”)这样做,理由是
.
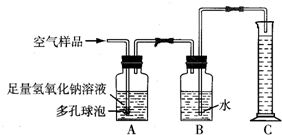
B.据报道,从2005年1月1日起,贵州省各地环保部门将对实验室类污染实施严格的环境监管.由于学校化学实验室要排放成分复杂的污染物,所以也被列为环境监管范围.某校化学兴趣小组的同学在甲实验室中进行了氧气分别与碳、硫、铁反应的实验后,为了解该实验产生的气体对空气成分造成的影响,接着设计了如下实验装置进行实验(图中多孔球泡的作用是:增大气体与溶液的接触面积,使反应充分进行).请回答下列问题:
(1)实验在没有受污染的乙实验室中进行,取出适量甲实验室中空气样品的方法是
;
(2)将取得的空气样品按如图所示的装置进行实验测定:装置A的作用是
,其中发生反应的化学方程式为
;装置B中的现象是
;装置C的作用是
;
(3)若通入空气样品100mL,实验结束后,量筒中液体的体积为99mL(导管内液体忽略不计),说明装置
中吸收了1mL气体.若这些气体大量排放到空气中,因产生
,会对环境造成不利影响;
(4)请写出你在做化学实验时,减少实验对环境污染的一种做法:
.

 天天向上口算本系列答案
天天向上口算本系列答案 某校化学课外活动小组的同学需要一些硫酸做化学实验.现有一瓶未开启的浓硫酸,标签如图.请阅读标签上的说明,回答下列问题.
某校化学课外活动小组的同学需要一些硫酸做化学实验.现有一瓶未开启的浓硫酸,标签如图.请阅读标签上的说明,回答下列问题.
 A.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.只要下雨就下酸雨,对该镇环境造成极大破坏.
A.某镇有座硫酸厂,设备简陋,技术陈旧,该厂每天排放大量含SO2的废气和含H2SO4的酸性废水.当地的其他工厂和居民均用煤炭作燃料.只要下雨就下酸雨,对该镇环境造成极大破坏. 某校化学课外活动小组的同学需要一些硫酸做化学实验.现有一瓶未开启的浓硫酸,标签如图.请阅读标签上的说明,回答下列问题.
某校化学课外活动小组的同学需要一些硫酸做化学实验.现有一瓶未开启的浓硫酸,标签如图.请阅读标签上的说明,回答下列问题.