
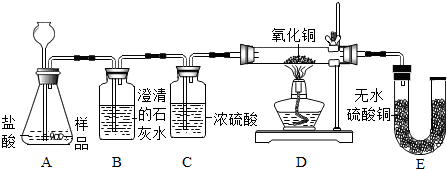
分析 (1)若样品中含有CaCO3,它会与盐酸反应,生成气体;产生的气体能与澄清石灰水反应;若样品中含有Fe,它与盐酸反应生成能还原氧化铜的氢气,还原氧化铜时有水生成;
(2)根据碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳解答;根据铁与稀盐酸反应,生成氯化亚铁和氢气解答;
(3)样品中成分可能未完全变质,可能含有氧化钙,并依据氧化钙和水反应生成氢氧化钙的性质解答;
(4)根据氧化铁与稀盐酸反应生成氯化铁和水解答;
(5)根据浓硫酸具有吸水性解答.
解答 解:(1)若样品中含有CaCO3,CaCO3能与盐酸反应生成二氧化碳气体,观察到的实验现象是生成的气体二氧化碳进入B,与其中的其中的澄清石灰水反应生成沉淀,反应方程式是CO2+Ca(OH)2=CaCO3↓+H2O;
若样品中含有Fe,Fe与盐酸反应生成氢气,氢气到达D装置后还原氧化铜,生成铜和水,反应中黑色粉末变为红色;水蒸气进入E装置,可以看到E中的无水硫酸铜变蓝;
(2)据碳酸钙和稀盐酸反应,生成氯化钙、水和二氧化碳,反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;铁与稀盐酸反应,生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)因为小袋上面标有成分:CaO、Fe,其中的CaO可能有部分未变质;可能会吸收空气中的水分,生成Ca(OH)2,二者都是灰白色固体,所以灰白色粉末中还应该有CaO或Ca(OH)2.了验证该物质的存在,有同学取一部分袋内灰白色粉末加水充分溶解、过滤,再向滤液中滴加酚酞溶液,若液体变红色,则证明了该物质的存在;
(4)氧化铁与稀盐酸反应生成氯化铁和水.该反应的化学方程式为:Fe2O3+6HCl=2FeCl3+3H2O;
(5)浓硫酸具有吸水性,为防止空气中的水蒸气进入E中,在E装置后增加盛有浓硫酸的洗气瓶.才使实验更有说服力.
故答案为:
(1)澄清的石灰水变浑浊;CO2+Ca(OH)2=CaCO3↓+H2O;黑色固体变成红色;
(2)Fe+2HCl=FeCl2+H2↑;
(3)Ca(OH)2 ;酚酞溶液;
(4)Fe2O3+6HCl=2FeCl3+3H2O;
(5)浓硫酸.
点评 本题考查了物质的化学性质及反应时的现象和根据化学方程式的计算,因此熟练掌握物质的化学性质、方程式的书写,再结合题中情境不难解答.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:实验探究题
 某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装罝(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.
某学习小组对课本中“食盐常用于制氧气、烧碱”的内容产生兴趣.在老师的指导下,用自制的实验装罝(主体部分如图所示)进行电解饱和食盐水制取氢氧化钠的实验.一段时间后,关闭电源,从K处导出部分的溶液作为待测液进行如下探究.| 实验步骤 | 实验现象 | 实验结论 |
| 待测液呈碱性,表明含有氢氧化钠 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用汽油洗涤油污是乳化作用 | |
| B. | 化学反应中一定有能量的变化 | |
| C. | 合金一定是由两种以上金属熔合而成的 | |
| D. | 氯化铵与熟石灰混合施用,既施了氮肥又改良了酸性土壤 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 千锤万凿出深山 | B. | 烈火焚烧若等闲 | C. | 粉身碎骨浑不怕 | D. | 要留清白在人间 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | CuS04+2NaOH=Cu(OH)2+Na2S04 | B. | 6CO2+6H2O$\frac{\underline{\;光照\;}}{\;}$C6H12O6+6O2↑ | ||
| C. | P+O2$\frac{\underline{\;点燃\;}}{\;}$P2O5 | D. | Fe203+6HCI=2FeCI3+3H20 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验CH4中是否含有H2 | 将气体点燃 |
| B | 鉴别NaOH溶液和Ca(OH)2溶液 | 分别向溶液中通CO2 |
| C | 除去NaCl中的Na2CO3 | 向其中加入足量稀盐酸 |
| D | 比较铁和铜的活动性顺序 | 将其分别加ZnSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com