
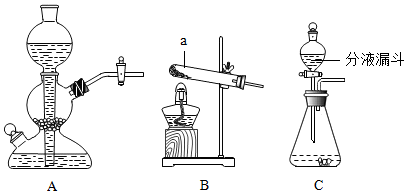
| 试验编号药品 | 甲 | 乙 | 丙 | 丁 |
| 大理石 | mg,块状 | mg,块状 | mg,粉末状 | mg,粉末状 |
| 盐酸(过量) | wg,稀盐酸 | wg,浓盐酸 | wg,稀盐酸 | wg,浓盐酸 |
| 目的 | 原料 | 发生装置 | 气体较平稳产生的最主要的一个原因 |
| 制取二氧化碳 | 块状大理石稀盐酸 | A | 反应物的接触面积较小 |
| 制取氧气 | 粉末状二氧化锰 3%的过氧化氢溶液 | C | 通过分液漏斗控制液体滴加速度 |
分析 (1)根据实验装置的连接顺序以及实验中的注意事项来分析;
(2)大理石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;根据实验数据分析比较解答;
(3)进行对比试验要确定好常量和变量;浓盐酸易挥发;
块状大理石和稀盐酸接触面积不大,并且比较均匀;
分液漏斗能够控制液体样品的流量,从而可以控制反应速率.
解答 解:(1)在组装B装置时,应先放好酒精灯,然后根据酒精灯的高度来安装试管,实验结束后,先移出水中的导管,再熄灭酒精灯,以防冷水倒吸,炸裂试管;
故填:前;先移出水中的导管,再熄灭酒精灯;
(2)Ⅰ、碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;故填:CaCO3+2HCl═CaCl2+H2O+CO2↑;
Ⅱ、对比实验数据可见,甲和乙均为mg块状大理石,wg盐酸,但是盐酸的浓度不同,故填:甲;
甲和丙对比,乙和丁对比可知,实验研究的另一个影响反应的因素是固体反应物的颗粒大小(或反应物的接触面积);故填:固体反应物的颗粒大小(或反应物的接触面积);
(3)Ⅰ、甲和丁对比可知,丁中反应之间的接触面积大,盐酸浓度大,所以反应的速率更快;
丁为浓盐酸,具有挥发性,所以溶液的质量更小;
因为并不知道大理石与盐酸是否完全反应还是哪一种物质有剩余,故无法判断产生二氧化碳的质量粉末状大理石利用率.
故填:ab;
Ⅱ、用块状大理石与稀盐酸反应来较平稳的产生二氧化碳,是因为块状大理石与稀盐酸的接触面积较小;用过氧化氢来制取氧气时,用分液漏斗滴加过氧化氢溶液,这样就可以控制液体滴加的速度,从而得到了较平稳的氧气流.故填:反应物的接触面积较小;通过分液漏斗控制液体滴加速度.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.


科目:初中化学 来源: 题型:实验探究题
 双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.
双吸剂”是一种常见袋装食品的保鲜剂,能吸收空气中的氧气、二氧化碳、水蒸气 等.化学兴趣小组的同学在某食品袋中发现一包“双吸剂”,其标签如图所示.| | 实验现象 | 实验结论 |
| ①取少量样品放入试管中,滴加一定量的 稀盐酸.用带异營的单孔橡皮塞塞紧试管口,导管另 一端伸入澄清石灰水中. | 试管中固体逐漸减少,有大量无色气体产生,得到浅绿色溶液,澄清石灰水变浑浊. | 样品中一定含有 Fe和CaCO3 不含Fe203. |
| ②取少量样品放入试管中,加水 溶解,静置后取上层清液滴加无 色酚酞试液. | 试管底部有不溶物,上层清液由无色变为红色. | 样品中含有 氧化钙或氢氧化钙或二者都有. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
 实验室有一瓶保管不当的试剂,其残缺的标签如图.已知它是无色液体,是初中化学常用的试剂.同学们对此很感兴趣,决定对其成分进行探究:
实验室有一瓶保管不当的试剂,其残缺的标签如图.已知它是无色液体,是初中化学常用的试剂.同学们对此很感兴趣,决定对其成分进行探究:| 物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
| 溶解度g | 36 | 109 | 215 | 9.6 |
| 操作步骤 | 实验现象 | 结论 |
| 取样于试管中,滴加无色酚酞 | 溶液呈红色 | 该溶液是NaOH溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
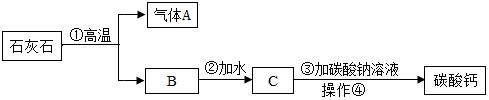
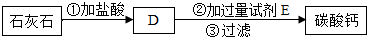
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 6.3% | B. | 12.6% | C. | 19.9% | D. | 25.2% |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
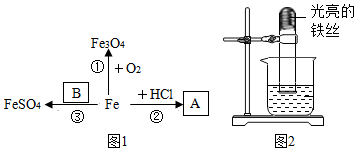
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 燃着的木条伸入盛放某气体的集气瓶中熄灭,该集气瓶中一定是二氧化碳 | |
| B. | 置换反应都有单质生成,所以有单质生成的反应一定是置换反应 | |
| C. | 氧气和臭氧都是氧元素组成的单质,所以不同的物质可能由同种元素组成 | |
| D. | 碱都是含有氢元素的化合物,因此含有氢元素的化合物一定是碱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com