
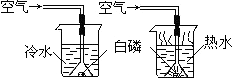
 23、(1)小明同学用图示装置探究燃烧的条件,得到以下事实:①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是
23、(1)小明同学用图示装置探究燃烧的条件,得到以下事实:①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是




科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
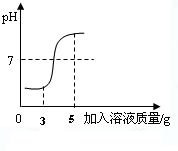
| 溶质 | H2SO4 | HCl | H2S | H2CO3 | HClO |
| pH | 小→大 | ||||
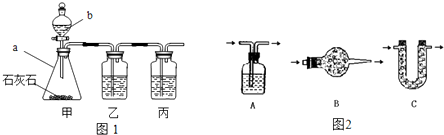
| 实验步骤 | I将适量盐酸加入烧杯中并称量 | II称取少量大理石样品加入烧杯中,使之与过量稀盐酸反应 | III待反应完全后,称重 |
| 实验图示 |  | ||
| 实验数据 | 烧杯和盐酸的质量为100.0g | 大理石样的质量为12.0g | 烧杯和其中混合物的质量为107.6g |
查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| 验证猜想 | 实验操作 | 实验现象 | 实验结论 |
猜想① |
氧气的浓度越大,燃烧越剧烈 | ||
猜想② |
_________燃烧越剧烈 |
查看答案和解析>>
科目:初中化学 来源:2009-2010学年粤教版九年级(上)第四次段考化学试卷(解析版) 题型:解答题
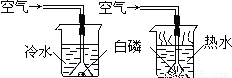 (1)小明同学用图示装置探究燃烧的条件,得到以下事实:①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是______(填序号,下同);能证明可燃物必须达到一定的温度(着火点)才能燃烧的实验事实是______.
(1)小明同学用图示装置探究燃烧的条件,得到以下事实:①不通空气时,冷水中的白磷不燃烧;②通空气时,冷水中的白磷不燃烧;③不通空气时,热水中的白磷不燃烧;④通空气时,热水中的白磷燃烧.该实验中,能证明可燃物通常需要接触空气才能燃烧的实验事实是______(填序号,下同);能证明可燃物必须达到一定的温度(着火点)才能燃烧的实验事实是______.| 验证猜想 | 实验操作 | 实验现象 | 实验结论 |
猜想① | 氧气的浓度越大,燃烧越剧烈 | ||
猜想② | _________燃烧越剧烈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com