
【题目】金属镁是一种重要的金属。小明在做镁带燃烧实验时,发现从实验室中取出来的镁条表面呈灰黑色,这灰黑色物质是什么呢?是氧化镁吗?小明想了一下,很快就把它否定了,他的理由是 。小明通过查阅资料灰黑色固体为碱式碳酸镁。
【查阅资料】1.碱式碳酸镁有多种组成。如Mg2(OH)2CO3、Mg4(OH)2(CO3)3、等,可以表示为xMgCO3·yMg(OH)2(x、y都是正整数)。
2.MgCO3![]() MgO +CO2 ↑ ;Mg(OH)2
MgO +CO2 ↑ ;Mg(OH)2![]() MgO +H2O
MgO +H2O
3.碱式碳酸镁能与盐酸反应生成氯化镁、二氧化碳和水。
Ⅰ.确定镁带表面碱式碳酸镁的成分
小明同学为确定镁带表面碱式碳酸镁的组成,设计如图所示的实验:
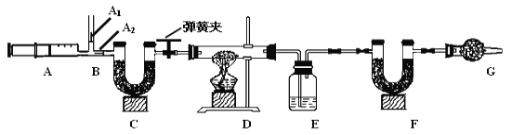
图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
【实验步骤】
①按图组装好仪器后, ;
②称取灰黑色样品,并将其放入硬质玻璃管中;
③打开弹簧夹,反复推拉注射器;
④称量E、F的质量,E的质量为87.6g,U型管F的质量为74.7g;
⑤关闭弹簧夹,加热D处试管直到反应不再进行;
⑥打开弹簧夹,再次反复缓缓推拉注射器;
⑦再次称量E、F的质量,E的质量为89.4g,U型管F的质量为87.9g。
【问题讨论】
(1)补充好实验步骤 ,E中所装药品是 ;
(2)C、F、G中装有碱石灰(CaO与NaOH的固体混合物),则C的作用是 ,若没有G装置,则测定的x的值会 (填“偏大”、“偏小”、“无影响”);
(3)步骤⑥目的是 ;
(4)根据上述实验数据,推算该碱式碳酸镁的化学式为 。
Ⅱ.测定镁带样品纯度

【问题讨论】
(5)装置B的作用是 ,装置C的作用是 ;
(6)称取1.0g镁带样品与足量浓盐酸充分反应后,收集到的氢气的体积为0.448 L(已知该实验条件下氢气的密度为0.089g/L),计算镁带样品纯度(写出计算过程,2分)
(7)有同学认为用这种方法测定的结果一定偏大,原因是 ;
(8)小江同学认为测定产物中CO2的质量(即反应前后装置②的质量差)也可测定样品中单质镁的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果偏低,你认为原因可能是 。(填序号)
①浓盐酸易挥发,产生的氯化氢气体被装置
②二氧化碳气体逸出时带出的水蒸气在装置B中冷凝而被吸收
③装置A、B内空气中的二氧化碳被装置B吸收
④实验结束时烧瓶中残留二氧化碳
⑤气体从氢氧化钠溶液中逸出时带走部分水蒸气
【答案】 MgO为白色
Ⅰ.确定镁带表面碱式碳酸镁的成分
检查气密性 浓硫酸
(1)防止空气中二氧化碳和水进入F 、变大
(2)使产生的气体全部进入EF
(3)3Mg(OH)2. Mg(OH2
Ⅱ.测定镁带样品纯度
(5)除CO2 和 HCl 检验二氧化碳是否除尽
(6)48%
(7)滴加的盐酸占一定体积
(8)①②③
【解析】
试题分析:因为MgO是种白色的固体,
Ⅰ.确定镁带表面碱式碳酸镁的成分:
(1)组装好仪器首先要检查装置的气密性,E中所装药品是浓硫酸,进行吸收生成的水,
(2)C的作用是防止空气中二氧化碳和水进入F;若没有G装置测定的x的值会变大
(3)步骤⑥目的是使产生的气体全部进入EF
Ⅱ.测定镁带样品纯度
(5)A装置中产生CO2、H2,还挥发HCl气体,装置B的作用是除CO2 和 HCl;装置C的作用是检验二氧化碳是否除尽
(6)设镁带样品纯度为x
Mg+2HCl==MgCl2+H2↑
24 2
1gx 0.448L×0.089g/L
24/2===1gx/(0.448g/L×0.089g/L)
X=48%
(7)测定的结果一定偏大,原因是滴加的盐酸占一定体积


 星级口算天天练系列答案
星级口算天天练系列答案科目:初中化学 来源: 题型:
【题目】下列关于物质的变化或物质的性质判断正确的是( )
A.生石灰变成熟石灰是物理变化
B.干冰升华是化学变化
C.蔗糖易溶于水是蔗糖的物理性质
D.铜能导电是铜的化学性质
查看答案和解析>>
科目:初中化学 来源: 题型:
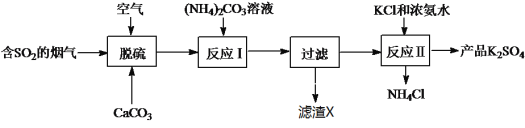
【题目】某热电厂用脱硫方法得到CaSO4生产K2SO4的工艺流程如下。
【资料】碳酸铵在水溶液中温度高于70℃时开始分解。
请回答下列问题:
(1)脱硫反应中的碳酸钙需要粉碎其目的是 ;
(2)脱硫过程的化学方程式为:2CaCO3 +2 SO2 +O2+4H2O=2CaSO4·2H2O +2 ;
(3)实验室完成过滤操作所需的仪器有铁架台、玻璃棒、烧杯以及 (填字母序号),滤渣X的化学式为 ;
(4)产品K2SO4在农业生产中可做农作物生长的 (填写一种用途),将NH4Cl溶液通过: 、降温结晶、过滤、洗涤、干燥等操作步骤得副产物NH4Cl晶体;
(5)反应Ⅰ的温度需要控制在60~70℃,其原因为 ;
A.60~70℃反应速率较快
B.高于70℃时碳酸铵分解,降低了原料的利用率
(6)(NH4)2SO4与KCl溶液需在浓氨水中发生反应Ⅱ,析出K2SO4晶体,其中浓氨水的作用是
(7)下列洗涤产品K2SO4晶体的方法中,你认为最好的方法是 。
A.常温时蒸馏水洗 B.冰水洗 C.饱和硫酸钾溶液洗
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。
(1)用化学符号表示:
①2个氮原子 ;
②4个氨分子 ;
③亚铁离子 ;
④氧化铝中铝元素的化合价 。
(2)用字母序号填空:
A.硫酸铜
B.聚乙烯
C.干冰
D.氧化钙
E.氢气
F.碳酸钠
①配制波尔多液的一种盐 ;
②用于包装食品的是 ;
③侯德榜制得的“碱” ;
④用作食品干燥剂的是 ;
(3)写出下列反应的化学方程式:
①铁丝在氧气中燃烧 ;
②湿法冶金 ;
③稀硫酸除去铁锈 ;
④肼(N2H4)完全燃烧生成氮气和一种常见的液体 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛,以菱镁矿(主要成分为MgCO3,含少量FeCO3,其他杂质不溶,也不参加反应)为原料制备高纯氧化镁的实验流程如下:
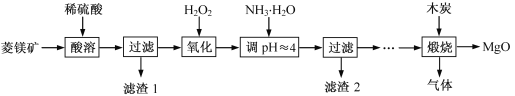
资料:① 不同氢氧化物沉淀的pH范围:
氢氧化物 | Fe(OH)3 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 8.6 |
完全沉淀的pH | 3.2 | 11.1 |
② 硫在常温下是一种淡黄色固体,硫的熔点约为115.2℃,沸点约为444.7℃;
③ 高锰酸钾溶液只吸收SO2,不吸收CO2;
④ 碱溶液既吸收SO2,又吸收CO2。
试回答下列问题:
(1)MgCO3与稀硫酸反应的化学方程式为 。
(2)加入H2O2目的是在酸性条件下将FeSO4氧化成Fe2(SO4)3,同时生成水,发生反应的化学方程式为 。
(3)加氨水调节溶液的pH约为4的目的是 ,反应的化学方程式为
。
(4)煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C![]() MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C![]() MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。(假设每步反应都完全进行)
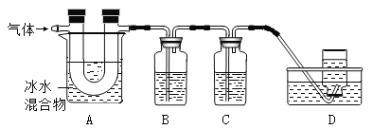
① A中现象是:玻璃管壁出现 色固体;
② B中盛放的溶液可以是 (填字母),实验现象为 ;
a.Ca(OH)2 溶液 b.Na2CO3 溶液 c.稀硝酸 d.KMnO4溶液
③ D中收集的气体是 (填化学式)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】稀硫酸与氢氧化钠溶液混合没有明显现象,为证明硫酸与氢氧化钠发生了化学反应,小颖同学进行了如下探究:

(1)小颖同学通过图一所示的实验,证明硫酸与氢氧化钠发生了化学反应,她依据的实验现象是 。
(2)氢氧化钠是实验室常用药品,下列相关说法中,正确的是 (填序号)。
A.称量:可将NaOH固体直接放在天平左边托盘的纸上进行称量
B.溶解:NaOH固体溶于水时放出大量热,溶解时需用玻璃棒不断搅拌
C.应急:先用大量水冲洗皮肤上的NaOH溶液,再涂上3%~5%稀盐酸溶液
D.保存:NaOH固体易吸收空气中的水蒸气和CO2,应密封保存
(3)溶液的pH与加入稀硫酸的质量关系如图二所示,图中A点对应溶液中的溶质有 (写化学式)
(4)根据图示信息,当溶液恰好为中性时,求所得不饱和溶液中溶质的质量。(不计滴加的酚酞试液质量,计算精确到0.01g)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】现有五种物质:①明矾、②干冰、③氦气、④酒精、⑤氮气,请选择相应物质的序号填空:
(1)空气中含量最多的气体是 ;
(2)实验室中常用的燃料是 ;
(3)可用于人工降雨的是 ;
(4)探空气球中常填充的气体是 ;
(5)净水时吸附水中微小颗粒物的是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com