
【题目】下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,F为一种常见的碱溶液,下图是它们之间的相互转化关系。请回答:
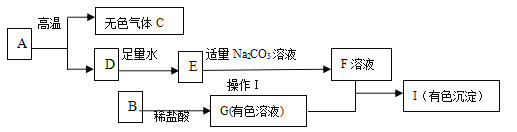
(1)写出下列物质的化学式:A___________ 、E______________。
(2)若I是蓝色色沉淀,请写出G+F![]() I的化学方程式:_______,并指出反应的基本类型:______反应。
I的化学方程式:_______,并指出反应的基本类型:______反应。
(3)若I是红褐色沉淀,则G溶液中应该含有的金属离子是________(用符号表示)
【答案】CaCO3 Ca(OH)2 CuCl2+2NaOH=Cu(OH)2↓+2NaCl 复分解 Fe3+
【解析】
A是建筑材料的主要成分,A是碳酸钙,碳酸钙发生分解反应生成氧化钙、二氧化碳,C是二氧化碳,D是氧化钙。氧化钙与水反应生成氢氧化钙,E是氢氧化钙。Na2CO3+Ca(OH)2 =CaCO3↓+2NaOH,F是氢氧化钠。B属于氧化物,能与稀盐酸反应生成有色溶液G,氢氧化钠与有色溶液G反应生成有色沉淀I,B可以是CuO或Fe2O3,发生的反应是CuO+2HCl=CuCl2+H2O或Fe2O3+6HCl=2FeCl3+3H2O,G是氯化铜或氯化铁,发生的反应是:CuCl2+2NaOH=Cu(OH)2↓+2NaCl或FeCl3+3NaOH=Fe(OH)3↓+3NaCl,I是Cu(OH)2或Fe(OH)3。将推出的各种物质代入转化关系中进行验证,推断正确。
(1)A是CaCO3 、E是Ca(OH)2
(2)若I是蓝色色沉淀,I是Cu(OH)2,G、F分别是CuCl2、NaOH,则G+F→I的化学方程式为:CuCl2+2NaOH=Cu(OH)2↓+2NaCl,两种化合物互相交换成分生成另外两种化合物的反应是复分解反应,该反应是复分解反应。
(3)若I是红褐色沉淀,I是Fe(OH)3,则G是FeCl3,FeCl3溶液中含有的金属离子是Fe3+。


科目:初中化学 来源: 题型:
【题目】下列应用及相关原理(用化学方程式表示)都正确的是( )
A.用含氢氧化镁的药物治疗胃酸过多症:![]()
B.实验室用稀硫酸和大理石制二氧化碳:![]()
C.用点燃的方法除去二氧化碳中混有的少量一氧化碳:![]()
D.用小苏打制干粉灭火器:![]()
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列图像能正确反映其对应关系的是
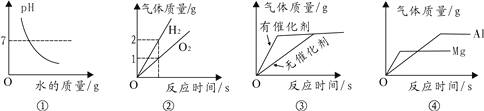
A. ①表示向NaOH溶液中不断加水稀释
B. ②表示水电解生成氢气与氧气的质量关系
C. ③表示用等质量、等质量分数的过氧化氢溶液制取氧气
D. ④表示分别向等质量、等质量分数的稀硫酸中加入足量的镁、铝
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是老师提供的一些实验室制取气体的装置,据图回答下列问题。
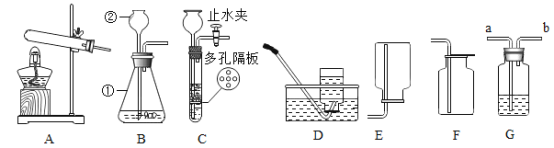
(1)写出装置图中标号仪器的名称:①________________,②________________。
(2)实验室用高锰酸钾制取O2,反应的化学方程式为________________。选择A为发生装置,实验时在试管口应放一团棉花,其目的是________________。
(3)实验室制取二氧化碳,为控制反应的发生和停止应选择的发生装置是_______________(填字母)。用G装置检验生成的二氧化碳,装置中的液体是_______________(填试剂名称),二氧化碳应从_______________(填“a”或“b” )端进入。
(4)通过查阅资料得知:氨气(NH3)是种密度比空气小且极易溶于水的气体。小明同学用加热氯化铵和氢氧化钙的固体混合物来制取氨气,他应选择的制备和收集装置组合是_______________(填字母)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是A、B两种固体物质的溶解度曲线。据图回答:

(1)P点表示的意义是在t1℃时,A、B两物质的溶解度________。(填“相等”或“不相等”)
(2)把t2℃时等质量A、B两物质的饱和溶液降低到t1℃,析出晶体较多的是_______。
(3)当A中含有少量B物质时,可采用________(填“降温”或“蒸发”)结晶的方法提纯A物质。
(4)t2℃时,在100g水中放入______克A物质恰好形成饱和溶液, 此饱和溶液中溶质的质量分数为_____________。
(5)将t1℃时的A、B的饱和溶液升温至t2℃,所得A、B溶液的溶质质量分数大小关系是A____B(填“>”、“<”或“=”)。
(6)要使A的饱和溶液变为不饱和溶液,除加水之外还可采用的方法是___________填一种)。
(7)t2℃时,分别将质量为50克的A、B固体用水完全溶解,所得溶液质量是A______B(填 “>””<”“=”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】酸、碱、盐是有广泛用途的重要化合物,它们的性质、制法等是化学研究的重要内容。
(1)侯德榜先生是我国制碱工业的先驱,请用化学方程式表示“侯氏制碱法”中的如下反应:向饱和食盐水中先后通入足量NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥__________。
(2)向盛有一定量澄清石灰水的烧杯中,逐滴滴加稀盐酸,用pH传感器测得溶液的pH与加入稀盐酸的关系曲线如图。
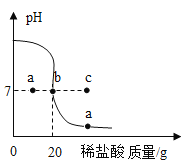
①请写出上述反应的化学方程式__________。
②若把原烧杯中澄清石灰水换为等质量、等浓度的氢氧化钠溶液进行该实验,则pH传感器测得的曲线可能经过_________(填“a”、“b”或“c”)点。
(3)为了除去NaCl溶液中含有少量的CaCl2、MgSO4可溶性杂质,向溶液中先后加入Ba(OH)2、Na2CO3、稀盐酸三种溶液。实验过程如图所示。(提示:微溶物不形成沉淀)。
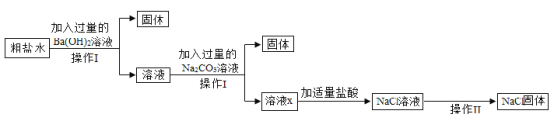
①操作Ⅰ和操作Ⅱ都要用到玻璃棒,在操作Ⅱ中玻璃棒的作用什么__________?
②以上实验过程中所发生的复分解反应共有__________个。
③用实际参加反应的离子符号来表示反应的式子叫做离子方程式,复分解反应的实质就是反应物的离子间结合生成了沉淀、气体或水。请用离子方程式表示Na2CO3与CaCl2反应的实质__________。
④溶液x中除氯化钠之外,还含有碳酸钠和氢氧化钠,请设计实验方案证明__________。(写出实验步骤、现象)。
(4)为测定某纯碱样品(含少量杂质氯化钠)中碳酸钠的质量分数,称取该样品25g,加入到盛有100g稀盐酸的烧杯中,恰好完全反应,反应后称得烧杯中剩余物质的总质量为116.2g。求纯碱样品中碳酸钠的质量分数__________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】微粒是构成化学物质的基础,下列对微粒的描述正确的是
A.仅由碳原子构成的物质属于单质
B.原子中一定含有质子、中子、电子
C.NaCl是由离子构成的,所以HCl也是由离子构成的
D.科学家成功制备出了一种含铱元素(Ir)的阳离子,在这种离子中,铱元素显+9价,则该离子符号为IrO4+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(1)净化水的方法有:①过滤、②加明矾吸附沉降、③蒸馏、④消毒杀菌。要将混有泥沙的天然水净化成生活用的自来水,应选用的方法和顺序为_____(填序号).
(2)如图是a.b.c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点。据图回答:
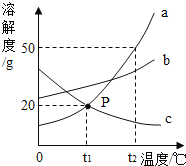
①P点的含义是__________________。
②t2℃时a、b、c三种物质的溶解度按由大到小的顺序排列是_____。
③若b中混有少量的a ,最好采用_____的方法提纯 b;
④t1℃时15ga物质加入到50g水中充分搅拌,得到溶液的质量为____g。
⑤将t2℃时等质量的a、b、c 三种物质的饱和溶液降温至t1℃时,所得溶液的溶质质量分数由大到小的顺序是______。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】茶叶是人们喜爱的饮品之一,科学研究证实茶叶中含茶氨酸(化学式为 C7H14N2O3)、锌、 硒等多种对人体有益的成分。请计算:
(1)锌、硒属于 (选填“常量”或“微量”)元素;
(2)茶氨酸中氢、氮元素的质量比 (填最简整数比);
(3)若茶氨酸中碳元素的质量为 4.2g,则茶氨酸的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com