
 如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.
如图是市场充气包装的食品,它使用的是什么气体呢?某兴趣小组对此进行了研究.| 我对气体的猜想是 | |
| 我猜想的依据是 |
| 实验方法及操作 | 可能观察到的现象及结论 |
分析 本题从食品的包装进行问题的分析,提出食品包装中的填充气体成分的探究.对于填充气体需要满足的条件,需要根据具体食品的要求来考虑.
解答 解:食品包装内的填充气体,一般需要满足的要求是:无毒、无异味、来源广、价格低廉,不和食品中任一成分反应.根据题目中学生的调查,工厂一般使用的是空气或者空气的一种成分,空气中含有氧气、氮气、二氧化碳、稀有气体等.由于氧气具有氧化性,很容易导致食品氧化变质,所以不宜用作填充气体.稀有气体相对较少,所以一般也不用于食品包装(高档食品也有使用的).
(1)提出猜想时就要围绕空气的成分和我们分析的填充气体需要满足的条件来进行,所以就提出了比如空气、二氧化碳、氮气甚至是稀有气体(从安全性角度来考虑时,一般工厂都选用空气,防止婴幼儿吸入填充气体造成窒息死亡).由于对于稀有气体我们不清楚其检验方法,所以在猜想时可以故意回避.
(2)论证猜想.论证猜想要先取样,尽可能要选择简单的操作,并且保证取样的准确性,然后针对猜想进行有关实验的验证.低于二氧化碳的猜想的检验,我们可以借助澄清石灰水(此处就不适合用燃着的木条,因为氮气同样不支持燃烧).至于怎么样让石灰水和气体接触,我们可以采取用盛有石灰水的注射器抽取包装袋内的气体,也可以用针将包装袋扎一小孔,然后挤压包装袋使气体喷到涂有石灰水的玻璃片或者内壁涂有石灰水的烧杯中.观察现象,若变浑浊,则为CO2.反之则不是.若不是CO2,那么就可能是氮气或者空气,这就可以借助燃着的木条来实验,因为木条在氮气不燃烧,在空气中更能够继续燃烧.
(3)根据题意充的气体是为了使食品能够较长时间地保鲜、保质,所以性质最稳定的是首选.因为是防止食品变质,所以所充气体首先应具备无毒、不和食品反应,从经济角度尽量选廉价气体.
故答案为:
(1)答案举例:
| 猜想一 | 猜想二 | 猜想三 | |
| 猜想是 | 空气 | 二氧化碳(CO2) | 氮气(N2) |
| 依据是 | 防止挤压变形 | 防止挤压变形或食品腐败 | 防止挤压变形或食品腐败 |
| 实验方法及操作 | 可能观察到的现象及结论 |
| (1)用针筒将包装袋内气体取出,将其压入澄清石灰水中 | 若澄清石灰水变浑浊,则包装袋内气体是二氧化碳 |
| (2)若澄清石灰水不变浑浊,再将包装袋内气体用针筒抽出,用排水法收集于集气瓶中,将燃着的木条伸入集气瓶内,观察燃烧情况 | 若木条正常燃烧,则包装袋内气体是空气,若木条熄灭,则包装袋内气体是氮气 |
点评 猜想和验证要在自己的能力范围内进行,因为提出猜想是需要我们用实验来验证的,要让自己能够验证才可以.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量样品溶于水,加入过量的氯化钙溶液; | 白色沉淀产生 | 该反应的化学方程式: Na2CO3+CaCl2═CaCO3↓+2NaCl; |
| (2)将上述反应后的混合物过滤,取滤液加入酚酞试液.. | 溶液变红色. | 证明猜想Ⅱ正确 |

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用煤作燃料 | B. | 用电饭煲煮饭 | ||
| C. | 用炸药爆破 | D. | 用压缩天然气作汽车燃料 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
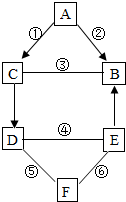 如图A、B、C、D、E、F都是初中化学常见的物质,其中B是常用于光合作用和灭火的气体.已知反应①、②、③的基本反应类型相同,反应④、⑤、⑥中,一个有沉淀生成,另一个有气体生成,还有一个没有明显现象.B、E不含相同元素,D、F只含一种相同元素.它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系)
如图A、B、C、D、E、F都是初中化学常见的物质,其中B是常用于光合作用和灭火的气体.已知反应①、②、③的基本反应类型相同,反应④、⑤、⑥中,一个有沉淀生成,另一个有气体生成,还有一个没有明显现象.B、E不含相同元素,D、F只含一种相同元素.它们之间的关系如图所示.(图中“-”表示两端的物质能发生化学反应;“→”表示物质间存在转化关系)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com