
分析 (1)根据酸的定义和酸具有一些相似的化学性质进行分析;
(2)根据碱性物质不能干燥酸性气体,氧化钙和水反应生成氢氧化钙进行分析;
(3)根据氢氧化铝和盐酸反应生成氯化铝和水进行分析.
解答 解:(1)在水溶液中电离出的阳离子全部是氢离子的化合物叫酸,所以在它们的水溶液里由于存在有相同的H+,酸与活泼金属反应生成盐和氢气,与碱反应生成盐和水;
(2)碱性物质不能干燥酸性气体,所以氢氧化钠可作某些气体的干燥剂,干燥氢气等气体,氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2;
(3)氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O.
故答案为:(1)H+,与活泼金属反应生成盐和氢气,与碱反应生成盐和水;
(2)氢气,CaO+H2O=Ca(OH)2;
(3)Al(OH)3+3HCl=AlCl3+3H2O.
点评 酸具有一些相似的化学性质,例如能使石蕊试液变红色,能和某些金属单质、某些金属氧化物、某些盐、碱反应生成相应的物质.


科目:初中化学 来源: 题型:选择题
| A. | 升高溶液温度 | B. | 降低溶液温度 | ||
| C. | 等温蒸发适量溶剂 | D. | 加入适量Ca(OH)2固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
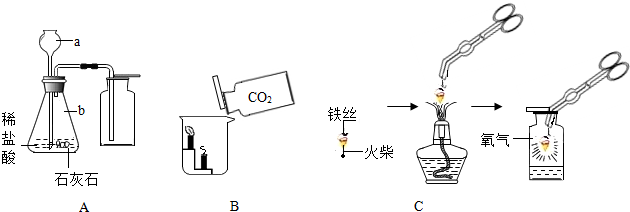
| 物质 | 镁条 | 含碳0.05%的铁丝 | 含碳0.2%的铁丝 | 含碳0.6%的铁丝 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | 剧烈燃烧 火星四射 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 某课外活动小组同学用图装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体).实验过程是:
某课外活动小组同学用图装置(固定装置未画出)测定含有杂质的镁带中镁单质的质量分数(杂质与酸接触不产生气体).实验过程是:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com