
【题目】金属和金属材料在生产、生活中有广泛的用途,请用金属的有关知识填空。
(1)锂电池可作为无人机的动力,其工作原理是:FePO4+Li![]() LiFePO4.在LiFePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
LiFePO4.在LiFePO4中锂元素显+1价,磷元素显+5价,则铁元素的化合价是_____。
(2)钛(Ti)具有硬度大,密度小,熔点高,抗腐蚀性能好等优良性能,被誉为“未来金属”。已知Ti2(SO4)3溶于水溶液呈紫色。Ti2O3(紫黑色固体)在加热条件下可溶于硫酸,生成Ti2(SO4)3.可观察的现象是_____,反应的化学方程式为_____。
(3)工业上,用一氧化碳和赤铁矿炼铁的化学方程式为_____,计算用1000t含氧化铁80%的赤铁矿石,理论上能冶炼出铁的质量为_____t。
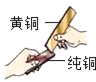
(4)黄铜片(铜锌合金)与铜片互相刻划时,(如图所示),纯铜片上留下明显的划痕,说明_____;
将它们分别放入稀硫酸中能产生气泡的是_____;涉及的化学反应可用化学方程式表示为_____。
【答案】+2 紫黑色的固体溶解/消失溶液由无色变成紫色 Ti2O3 + 3H2SO4![]() Ti2(SO4)3 + 3H2O 3CO + Fe2O3
Ti2(SO4)3 + 3H2O 3CO + Fe2O3 ![]() 2Fe + 3CO2 560 合金的硬度比组成它们的纯金属要大 黄铜片 Zn + H2SO4 ===ZnSO4 +H2↑
2Fe + 3CO2 560 合金的硬度比组成它们的纯金属要大 黄铜片 Zn + H2SO4 ===ZnSO4 +H2↑
【解析】
(1)在LiFePO4中锂元素显+1价,磷元素显+5价,氧元素显-2价,设铁元素的化合价为x,则(+1)+x+(+5)+(-2)×4=0,则x=+2;
(2)Ti2O3(紫黑色固体)在加热条件下与硫酸反应生成Ti2(SO4)3和水,观察到紫黑色固体溶解,溶液由无色变成紫色,反应的化学方程式为:Ti2O3+3H2SO4 ![]() Ti2(SO4)3+3H2O;
Ti2(SO4)3+3H2O;
(3)赤铁矿的主要成分是氧化铁,一氧化碳还原氧化铁的化学方程式是:3CO+Fe2O3![]() 2Fe+3CO2由质量守恒定律,反应前后铁元素的质量不变,1000t×80%氧化铁中铁元素的质量即为炼出铁的质量,160t氧化铁中铁元素的质量为1000t×80%×
2Fe+3CO2由质量守恒定律,反应前后铁元素的质量不变,1000t×80%氧化铁中铁元素的质量即为炼出铁的质量,160t氧化铁中铁元素的质量为1000t×80%×![]() =560t;
=560t;
(4)将纯铜片和黄铜片互相刻画,纯铜片上留下明显的划痕,说明黄铜的硬度比纯铜的硬度大;
(5)黄铜中的锌会与硫酸反应生成氢气和硫酸锌,将它们分别放入稀硫酸中能产生气泡的是:黄铜片,化学方程式为:Zn + H2SO4 =ZnSO4+H2↑。


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
【题目】工业铁红的主要成分是Fe2O3,还含有少量的FeO、Fe3O4,为了测定铁红中铁的质量分数,兴趣小组的同学进行了如下实验,请你参与过程分析。
(资料1)草酸晶体(H2C2O43H2O)在浓H2SO4作用下受热分解,化学方程式为:
H2C2O43H2O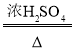 CO2↑+CO↑+4H2O
CO2↑+CO↑+4H2O
(问题讨论)用如图所示装置进行实验:
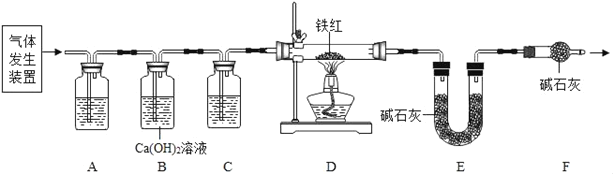
(1)实验前应先检查装置的气密性。
(2)进入D中的气体是纯净、干燥的CO,则A、C中的试剂依次是_____(填字母编号)
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液
(3)B装置的作用是_____。
(4)对D装置加热前和停止加热后,都要通入过量的CO,其作用分别是:
①加热前将装置中的空气排出,防止发生爆炸
②停止加热后_____。
(数据分析与计算)
(资料2)铁的常见氧化物中铁的质量分数
铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
铁的质量分数 | 77.8% | 70.0% | 72.4% |
(5)称取铁红样品10.0g用上述装置进行实验,测定铁红中铁的质量分数。
①D中充分反应后得到Fe粉的质量为mg,则m的取值范围是_____。
②实验前后称得E装置增重6.6g,则此铁红中铁的质量分数是_____。(计算结果精确到0.1%)
(实验评价)
(6)本实验中如果缺少C装置(不考虑其它因素),则测得样品中铁的质量分数会_____(填“偏小”、“不变”或“偏大”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】除去下列各物质中含有的少量杂质,所选用的试剂、操作方法都正确的是( )
选项 | 物质 | 杂质 | 操作方法 |
A | CaO固体 | CaCO3固体 | 加入足量水,过滤 |
B | CuSO4溶液 | H2SO4 | 加入过量CuO粉末,过滤 |
C | NaOH溶液 | Ca(OH)2 | 加入过量Na2CO3溶液,过滤 |
D | KNO3溶液 | K2CO3 | 加入适量CaCl2溶液,过滤 |
A. AB. BC. CD. D
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列做法或说法中不合理的是( )
A. 硬水易生水垢,日常生活中可以用肥皂水区分硬水和软水
B. 利用洗洁精的乳化作用可以洗去餐具上的油污
C. 人体缺少必需微量元素会得病,因此应尽可能多吃含有这些元素的营养补剂
D. 将10g 98%的浓硫酸沿烧杯壁缓慢地注入盛有90g水的烧杯中,用玻璃棒不断搅拌,即可配得9.8%的稀硫酸(不考虑水受热蒸发)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(12分)氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
【阅读资料】
①碱石灰是氧化钙和氢氧化钠的混合物。
②钙遇水立即发生剧烈反应生成氢氧化钙和氢气。
③氢化钙要密封保存,遇水反应生成氢氧化钙和氢气。
【氢化钙的制备】
氢化钙通常用氢气与钙加热制得。某化学兴趣小组设计的制取装置如图10所示(固定装置省略)。
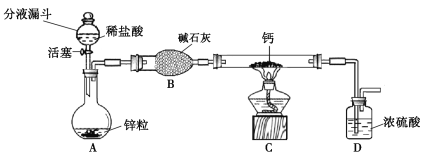
图10
回答下列问题:
(1)装置A中制取氢气的化学方程式为 。
(2)装置B的作用是 。
(3)装置C中制取氢化钙的化学方程式为 。
(4)若不改变温度,整套装置气密性的检查方法是 。
【产品的定量测定】
通过上述方法制得的氢化钙样品中常混有未完全反应的钙(其余可能的杂质忽略不计)。样品纯度的测定步骤如下:
①检查装置气密性,装入药品,按图11(固定装置省略)所示连接仪器。
②调整水准管高度,使量气装置两边的液面保持同一水平。读取液面所在的刻度数据为10.0 mL。
③将Y形管慢慢倾斜,直到A端的水全部与B端的样品混合。
④反应结束,冷却至室温,再次读取液面所在刻度数据为110.0 mL。
回答下列问题:
(5)如何判断样品与水完全反应: 。
(6)反应生成氢气的体积为 mL。
(7)已知该实验条件下,氢气的密度为0.09 mg/mL。样品中氢化钙的纯度为 。(结果精确到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】学习化学知识的目的之一是分析和解决实际的问题。
(1)日常生活中食用的蔬菜和水果中富含的营养素是_____。
(2)页岩气与天然气的主要成分都是甲烷。天然气与煤、_____合称为三大化石燃料。
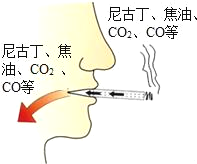
(3)吸烟有害健康。香烟烟气中含有几百种对人体有害的物质,如尼古丁、焦油、一氧化碳、二氧化碳等,其中与血红蛋白结合能力强的有毒气体是_____。
(4)物质在溶解时,常常会使溶液的温度发生改变。硝酸铵溶于水时,溶液的温度会_____。
(5)用洗涤剂清洗油污,是利用了洗涤剂的_____作用。
(6)测定地下水的酸碱度可用_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】甲、乙两种固体物质的溶解度曲线如图,下列说法中错误的是( )
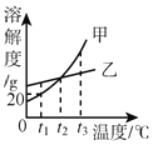
A. t1℃时,50g甲的饱和溶液中溶解了10g甲
B. 将t2℃时的甲、乙两种物质的饱和溶液升温至t3℃(溶剂的量不变),两种溶液中溶质的质量分数相等
C. t3℃时,将等质量的甲、乙饱和溶液降温至t2℃,溶液中溶质质量的关系是:甲<乙
D. 要除去甲的饱和溶液中混有的少量乙,可采用蒸发结晶的方法
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】向一定量的硝酸铜、硝酸银的混合溶液中加入5.6g铁粉,充分反应后过滤、洗涤、干燥,称得固体14g。向固体中加入稀盐酸,无气泡产生。则下列分析正确的是( )
A. 滤液中一定不含有硝酸银
B. 滤液中一定含有硝酸铜
C. 滤出的固体中一定没有铁
D. 滤出的固体中含有铜6.4g
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】把5.1g镁和铝的合金加入到一定质量、一定质量分数的稀硫酸中,恰好完全反应,产生0.5g H2,向反应后的溶液中加入一定量的NaOH溶液,恰好使上述溶液中的MgSO4 和Al2(SO4)3完全转化为沉淀,则同时生成的Na2SO4的质量为( )
A. 7.1gB. 28.4gC. 14.2gD. 35.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com